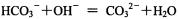下列关于常温下电解质溶液的叙述中 正确的是A.碳酸氢铵溶液和足量氢氧化钠溶液混合的离子反应:B.向一
下列关于常温下电解质溶液的叙述中,正确的是
|
参考解答
| B |
试题分析:A、NaOH为足量,则OH ̄与碳酸氢铵溶液中的HCO3 ̄、NH4+都发生反应,错误;B、不论氨水和盐酸量的多少,二者反应后的溶液一共含有4种离子:H+、NH4+、Cl ̄、OH ̄,根据电荷守恒可得关系式:c(H+)+c(NH4+)=c(Cl ̄)+c(OH ̄),正确;C、CO2的物质的量为0.2mol,NaOH的物质的量为0.3mol,发生两个反应:CO2+2NaOH=Na2CO3+H2O和CO2+NaOH=NaHCO3,根据化学方程式可得完全反应后生成的Na2CO3为0.1mol,NaHCO3为0.1mol,因为CO32 ̄的水解程度大于HCO3 ̄的水解程度,所以溶液中离子浓度大小顺序为:c(Na+) > c(HCO3 ̄)> c(CO32 ̄) > c(OH ̄) > > c(H+),错误;D、CH3COONa溶液中OH ̄来源于H2O的电离,因为pH=8,则c(OH ̄)=10-6mol?L ̄1,所以pH=8的0.1 mol·L-l CH3COONa溶液中由水电离出的c(OH ̄)=1.0×10-6mol?L ̄1,错误。 |
相似问题
下列离子方程式正确的是A.钠与水反应:Na+2H2O=Na+ +2OH- + H2↑B.硅酸钠溶液与
下列离子方程式正确的是A.钠与水反应:Na+2H2O=Na+ +2OH- + H2↑B.硅酸钠溶液与醋酸溶液混合:SiO3 2-+2H+=H2SiO3↓C.0 01mol L NH4Al(SO4)2 溶
下列离子方程式正确的是( )A.Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-B.双氧水
下列离子方程式正确的是( )A.Cl2通入水中:Cl2+H2O=2H++Cl-+ClO-B.双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2OC.用铜作电极电解
(16分)火力发电在我国的能源利用中占较大比重 但是排放出的SO2会造成一系列环境和生态问题 直接排
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。(1)用化学方
向FeBr2 FeI2的混合溶液中通入适量氯气 溶液中某些离子的物质的量变化如图所示 下列有关说法中
向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列有关说法中不正确的是A.d曲线代表溶液中Br—变化情况B.原溶液中F
下列化学反应的离子方程式书写正确的是( )。A.稀硝酸和过量铁屑反应:Fe+4H++NO3-=Fe
下列化学反应的离子方程式书写正确的是( )。A.稀硝酸和过量铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2H2OB.向硫酸氢铵溶液中加入少量氢氧化钠溶液: