(14分)Ⅰ(1)过渡金属元素有很多不同于主族元素的性质 如能形成多种配合物 如:Fe(CO)x [
| (14分)Ⅰ(1)过渡金属元素有很多不同于主族元素的性质,如能形成多种配合物,如:Fe(CO)x、[Fe(H2NCONH2)6] (NO3)3 [三硝酸六尿素合铁(Ⅲ)]、[Cu(NH3)4]SO4等。 ①Cu位于元素周期表第四周期第 族。 ②配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)。 (2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。 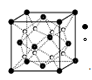 Ⅱ(3)液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。 ①写出羰基硫的电子式 ,羰基硫分子属于 (选填“极性”、“非极性”)分子。 ②下列能说明碳与硫两元素非金属性相对强弱的是 。 A.相同条件下水溶液的pH:Na2CO3>Na2SO4 B.酸性:H2SO3>H2CO3 C.CS2中碳元素为+4价,硫元素为-2价 ③羰基硫在水存在时会缓慢水解生成H2S,使溶液的pH约为6.5左右,此时钢铁设备会产生的电化学腐蚀主要是 。 |
参考解答
| Ⅰ(1)①ⅠB ;②分子晶体 ;(2)立方体 Ⅱ(3)① 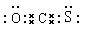 ; 极性 ②A C ③吸氧腐蚀 ; 极性 ②A C ③吸氧腐蚀 |
试题分析:Ⅰ(1)①Cu是29号元素,核外电子排布是2、8、18、1,因此在元素周期表中位于第四周期第ⅠB。②配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于分子晶体。(2)由该离子化合物的晶胞结构示意图可知:与O2-最近的Na+构成是是立方体结构。Ⅱ(3)①羰基硫(COS)是CO2分子中的一个O原子被S原子代替的结构,所以羰基硫的电子式是 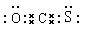 ;羰基硫分子属于极性分子;②A.NaOH是强碱,若某元素形成的含氧酸是强酸,则其水溶液是中性;若某元素形成的含氧酸是弱酸,则其钠盐呈碱性。因此相同条件下水溶液的pH:Na2CO3>Na2SO4可以证明C的非金属性比S弱。正确。B.元素的非金属性越强,该元素形成的最高价含氧酸的酸性越强,因此酸性:H2SO3>H2CO3.错误。C.两种非金属元素形成化合物,非金属性强的吸引电子能力就强,在化合物中显负化合价,元素非金属性弱的,在化合物中就表现正化合价。CS2中碳元素为+4价,硫元素为-2价,可以证明非金属性S>C。正确。③羰基硫在水存在时会缓慢水解生成H2S,发生反应的方程式是COS+H2O=H2S+CO2,使溶液的pH约为6.5左右,由于是弱酸性环境,所以此时钢铁设备会产生的电化学腐蚀主要是吸氧腐蚀。 ;羰基硫分子属于极性分子;②A.NaOH是强碱,若某元素形成的含氧酸是强酸,则其水溶液是中性;若某元素形成的含氧酸是弱酸,则其钠盐呈碱性。因此相同条件下水溶液的pH:Na2CO3>Na2SO4可以证明C的非金属性比S弱。正确。B.元素的非金属性越强,该元素形成的最高价含氧酸的酸性越强,因此酸性:H2SO3>H2CO3.错误。C.两种非金属元素形成化合物,非金属性强的吸引电子能力就强,在化合物中显负化合价,元素非金属性弱的,在化合物中就表现正化合价。CS2中碳元素为+4价,硫元素为-2价,可以证明非金属性S>C。正确。③羰基硫在水存在时会缓慢水解生成H2S,发生反应的方程式是COS+H2O=H2S+CO2,使溶液的pH约为6.5左右,由于是弱酸性环境,所以此时钢铁设备会产生的电化学腐蚀主要是吸氧腐蚀。 |
相似问题
下列A B两种元素的原子序数 其中可以组成AB2型离子化合物的是A.6和8 B.19和
下列A、B两种元素的原子序数,其中可以组成AB2型离子化合物的是A.6和8 B.19和16 C.12和17 D.10和8
简单原子的原子结构可用下图形象地表示 其中?表示质子 ○表示中子:①; ②;③。则下列有关这三种原子
简单原子的原子结构可用下图形象地表示,其中?表示质子,○表示中子:①;②;③。则下列有关这三种原子的叙述中正确的是A.属于不同的元素B.具有相同的
下列性质的递变中 正确的是A.O Na S的原子半径依次增大B.LiOH KOH CsOH的碱性依次
下列性质的递变中,正确的是A.O、Na、S的原子半径依次增大B.LiOH、KOH、CsOH的碱性依次增强C.HF、NH3、SiH4的稳定性依次增强D.HCl、HBr、HI的还原性依次减弱
(16分)X Y Z W是常见的四种短周期元素 其原子序数依次增大。其相关信息如下表:元素相关信息X
(16分)X、Y、Z、W是常见的四种短周期元素,其原子序数依次增大。其相关信息如下表:元素相关信息XX的基态原子最外层电子排布式为nsnnpnYY是空气中含量
下列大小关系比较正确的是A.离子半径:F-
下列大小关系比较正确的是A.离子半径:F-<Na+<Mg2+B.电负性:C<O<NC.氢化物的沸点:NH3<PH3<AsH3D.碱性: NaOH)>Mg(OH)2> Al(OH)3












