(16分)X Y Z W是常见的四种短周期元素 其原子序数依次增大。其相关信息如下表:元素相关信息X
(16分)X、Y、Z、W是常见的四种短周期元素,其原子序数依次增大。其相关信息如下表:
(2)Z的单质与W的单质相比熔点较高的是 (写化学式);Z与W原子半径较大的是 (写化学式) (3)X的一种氧化物XO2分子中σ键与∏键数目之比为 (4)X的第一电离能比W的 (填“大”或“小”) (5)写出X的单质与Y的最高价氧化物水化物的浓溶液在加热的条件下反应的化学方程式: (6)已知2.7gZ单质与足量Y单质反应,放出31.8kJ的热量,请写出此反应的热化学方程式: 。 |
参考解答
| (1)二周期ⅤA族,NH3;(2)Si,Al;(3)1:1;(4)大; (5)C+4HNO3(浓) 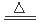 CO2↑+4NO2↑+2H2O;(6)2Al(s)+N2(g)=2AlN(s) ?H= —636KJ/mol CO2↑+4NO2↑+2H2O;(6)2Al(s)+N2(g)=2AlN(s) ?H= —636KJ/mol |
| 试题分析:根据题意可知X是C;Y是N;Z是Al;W是Si。(1)N位于元素周期表的二周期ⅤA族;由于非金属性N>Si。元素的非金属性越强,其简单的氢化物的稳定性就越强。因此稳定性强的是NH3;(2)Al的单质是金属晶体,通过金属键结合,Si的单质是原子晶体,原子间通过共价键结合,由于共价键是一种强烈的相互作用,断裂较难,所以相比熔点较高的是Si。虽然Al原子核外有3个电子层,而Fe原子核外有4个电子层,一般情况下,原子核外电子层数越多,原子半径就越大。但是影响因素的原子半径的大小的因素有很多,与各个轨道含有的电子数、离子的表面积大小等。Al的原子的半径是0.143nm,Fe原子的半径是0.127nm.,所以原子半径较大的是Al;(3)CO2分子的结构式是O=C=O,其中σ键与∏键数目之比为2:2=1:1。(4)由于C的原子半径比Si小,元素的非金属性C>Si,所以C的第一电离能比Si的大。(5)C的单质与浓HNO3在加热的条件下反应的化学方程式:C+4HNO3(浓)  CO2↑+4NO2↑+2H2O;(6)根据题意可得热化学方程式为2Al(s)+N2(g)=2AlN(s) ?H= —636KJ/mol。 CO2↑+4NO2↑+2H2O;(6)根据题意可得热化学方程式为2Al(s)+N2(g)=2AlN(s) ?H= —636KJ/mol。 |
相似问题
下列大小关系比较正确的是A.离子半径:F-
下列大小关系比较正确的是A.离子半径:F-<Na+<Mg2+B.电负性:C<O<NC.氢化物的沸点:NH3<PH3<AsH3D.碱性: NaOH)>Mg(OH)2> Al(OH)3
(24分)下表是元素周期表的一部分 针对表中①~⑩种元素 填写下列空白: 主族周期ⅠAⅡAⅢAⅣ
(24分)下表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:主族周期ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0族2①②③④3⑤⑥⑦⑧4⑨⑩(1)被选作相对原
[物质结构与性质]物质结构的多样性让人类使用的材料精彩纷呈。(1)图是原子序数相连的七种短周期元素第
[物质结构与性质]物质结构的多样性让人类使用的材料精彩纷呈。(1)图是原子序数相连的七种短周期元素第一电离能示意图。其中硼元素是(填图中元素代号)
下列说法正确的是A.第三周期金属元素的氧化物都属于碱性氧化物B.电子层结构相同的不同离子 其半径随核
下列说法正确的是A.第三周期金属元素的氧化物都属于碱性氧化物B.电子层结构相同的不同离子,其半径随核电荷数增大而减小C.IA族元素的金属性一定比IIA
(12分)【化学一物质结构与性质】已知A B C D均为前四周期元素且原子序数依次增大 元素A的基态
(12分)【化学一物质结构与性质】已知A、B、C、D均为前四周期元素且原子序数依次增大,元素A的基态原子2p轨道有3个未成对电子,元素B的原子最外层电子数是












