(12分) A B C D E均为短周期元素 且原子序数依次增大。已知B元素在自然界中组成化合物
| (12分) A、B、C、D、E均为短周期元素,且原子序数依次增大。已知B元素在自然界中组成化合物的种类最多;D原子最外层电子数与核外电子数之比为3:4;A与D、E与D均可组成原子个数比为1:1和2:1的两种化合物。据此回答: (1)由A、C、D三种元素可组成多种化合物,写出其中两种常见化合物的化学式 。 (2)在C和B组成化合物 (CB)2中,C、B原子均满足最外层8电子结构,,则(CB)2的电子式是 。 (3)化合物E3C与水反应的原理和氮化镁与水反应的原理相同,写出E3C与盐酸反应的化学方程式 。 (4)已知B与A可组成化合物甲,D与A可组成化合物乙,每个甲、乙分子中均含有18个电子 ① 甲在过量的D单质中充分燃烧,燃烧热是1559 kJ / mol,写出该反应的热化学方程式 。 ② 在酸性条件下,向FeI2的淀粉溶液中加入乙,溶液变蓝。当1mol Fe2+被氧化成Fe3+时,反应中电子转移为4 mol,写出该反应的离子方程式_______________。 |
参考解答
(1)HNO3、NH4NO3(2)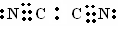 ;(3)Na3N + 4HCl = 3NaCl+NH4Cl ;(3)Na3N + 4HCl = 3NaCl+NH4Cl(4)① C2H6(g)+7/2 O2(g) = 2CO2 (g) + 3H2O;△H = 一1559 kJ / mol 或 2C2H6(g)+7 O2(g) = 4CO2 (g) + 6H2O (l) ;△H = 一3118 kJ / mol ② 2 Fe2+ + 6 I- + 4 H2O2 + 8 H+ =' 2' Fe3+ + 3 I2 + 8 H2O |
试题分析:根据题意可推知这几种元素分别是:A是H;B是C;C是N;D是O;E是Na。(1)由H、N、O三种元素可组成多种化合物,其中常见化合物的化学式是HNO2、HNO3、NH4NO3等。(2)在N和C组成化合物 (NC)2则(NC)2的电子式是 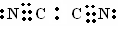 ;(3)Na3N与盐酸反应的化学方程式是Na3N + 4HCl = 3NaCl+NH4Cl;(4)根据题意可知:甲是C2H6;乙是H2O2。①结合已知条件可得乙烷燃烧的热化学方程式是:C2H6(g)+7/2 O2(g) = 2CO2 (g) + 3H2O;△H = 一1559 kJ / mol或2C2H6(g)+7 O2(g) = 4CO2 (g) + 6H2O (l) ;△H = 一3118 kJ / mol;②Fe2+ 和 6 I-都有还原性,而H2O2有氧化性,在酸性条件下二者发生氧化还原反应。根据质量守恒定律和电子守恒、电荷守恒的知识可得其离子方程式是:2 Fe2+ + 6 I- + 4 H2O2 + 8 H+ =' 2' Fe3+ + 3 I2 + 8 H2O。 ;(3)Na3N与盐酸反应的化学方程式是Na3N + 4HCl = 3NaCl+NH4Cl;(4)根据题意可知:甲是C2H6;乙是H2O2。①结合已知条件可得乙烷燃烧的热化学方程式是:C2H6(g)+7/2 O2(g) = 2CO2 (g) + 3H2O;△H = 一1559 kJ / mol或2C2H6(g)+7 O2(g) = 4CO2 (g) + 6H2O (l) ;△H = 一3118 kJ / mol;②Fe2+ 和 6 I-都有还原性,而H2O2有氧化性,在酸性条件下二者发生氧化还原反应。根据质量守恒定律和电子守恒、电荷守恒的知识可得其离子方程式是:2 Fe2+ + 6 I- + 4 H2O2 + 8 H+ =' 2' Fe3+ + 3 I2 + 8 H2O。 |
相似问题
原子序数依次增大的X Y Z W四种短周期元素 X W原子的最外层电子数与其电子层数相等 X Z的最
原子序数依次增大的X、Y、Z、W四种短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等。甲的化
以下表述不符合元素周期律的是A.酸性:H3PO4>HNO3>HClO4B.热稳定性:HF>H2O>N
以下表述不符合元素周期律的是A.酸性:H3PO4>HNO3>HClO4B.热稳定性:HF>H2O>NH3C.离子半径:F->Na+>Mg2+D.还原性:HI>HBr>HCl
短周期元素Q R T W在元素周期表中的位置如下 其中T原子的M层电子数比K层多2个 下列叙述不正确
短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是 ()A.H2R2的分子中既含有极性共价键,又含有非
现有短周期主族元素X Y Z R T。R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y Z2Y
现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡。六
下列判断中一定正确的是A.若X Y都是气态氢化物 且相对分子质量:X﹥Y 则沸点:X﹥YB.若X Y
下列判断中一定正确的是A.若X、Y都是气态氢化物,且相对分子质量:X﹥Y,则沸点:X﹥YB.若X、Y属于同主族元素,且相对原子质量:X﹥Y,则X的失电子能力












