KIO3为白色结晶粉末 溶于水 常温下稳定 833K以上分解.目前KIO3的制备方法有两种:方法一:
| KIO3为白色结晶粉末,溶于水,常温下稳定,833K以上分解.目前KIO3的制备方法有两种: 方法一:电解法.工艺流程如下: 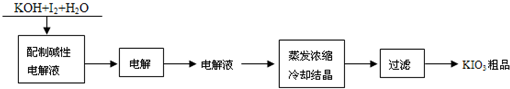 (1)配制碱性电解液的过程中,I2会发生氧化还原反应,生成KIO3和______(填化学式). (2)电解时,阳极和阴极的电极方程式分别是: ①阳极:______;②阴极:______. 方法二:氯酸钾氧化法.在酸性条件下,将氯酸钾(KClO3)与I2混合,反应后得到KH(IO3)2,再用KOH中和即得KIO3.有关化学反应方程式为:6I2+11KClO3+3H2O═6KH(IO3)2+5KCl+3Cl2 (3)KClO3氧化过程中,还原产物为______;每生成6mol KH(IO3)2,反应中转移的电子为______mol. (4)与“电解法”相比,“氯酸钾氧化法”的不足之处是(写出两条): ①______②______. |
参考解答
| (1)由I2会发生氧化还原反应,生成KIO3,I元素的化合价由0升高到+5价,则该反应中I元素的化合价一定降低为-1价,则还生成KI,故答案为:KI; (2)①碘离子向阳极移动,在阳极上失去电子生成碘酸根离子,阳极反应式为I-+6OH--6e-=IO3-+3H2O, 故答案为:I-+6OH--6e-=IO3-+3H2O; ②在阴极上水中的氢离子放电生成氢气,阴极反应式为2H2O+2e-=H2↑+2OH-,故答案为:2H2O+2e-=H2↑+2OH-; (3)由反应6I2+11KClO3+3H2O═6KH(IO3)2+5KCl+3Cl2可知,KClO3为氧化剂,Cl元素的化合价降低,则还原产物为KCl和Cl2,生成6mol KH(IO3)2时,转移的电子数为5mol×(5+1)+3mol×2×(5-0)=60mol, 故答案为:KCl和Cl2;60; (4)由反应6I2+11KClO3+3H2O═6KH(IO3)2+5KCl+3Cl2可知,该反应中生成氯气,污染环境且能腐蚀设备,原料的利用率不高, 故答案为:①生产过程中有氯气产生,易污染环境、腐蚀设备;②KClO3原料利用率不高. |
相似问题
实验室制备氯气的化学方程式为MnO2+4HCl(浓) △ . MnCl2+Cl2↑+2H2O 该
实验室制备氯气的化学方程式为MnO2+4HCl(浓)△ MnCl2+Cl2↑+2H2O,该反应中氧化剂与还原剂的物质的量之比为______,请将该化学方程式改写为离子方程式_
在下列反应中 属于氧化还原反应的是( )A.2H2O2 催化剂 . 2H2O+O2B.CaCO3
在下列反应中,属于氧化还原反应的是( )A.2H2O2催化剂 2H2O+O2B.CaCO3高温 CaO+CO2C.CaO+H2O=Ca(OH)2D.CaCO3+2HCl=CaCl2+CO2↑+H2O
氯酸是一种强酸 浓度超过40%时会发生分解 反应可表示为:a HClO3=bO2↑+cCl2↑+dH
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色
将Cu投入足量的FeCl3的水溶液中 两者发生反应的化学方程式如下:2FeCl3+Cu═2FeCl2
将Cu投入足量的FeCl3的水溶液中,两者发生反应的化学方程式如下:2FeCl3+Cu═2FeCl2+CuCl2(1)请用双线桥法标出电子转移的方向和数目.(2)在该反应中
在某体系内有反应物和生成物5种物质:H2S S FeCl3 FeCl2 HCl.已知H2S为反应物
在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知H2S为反应物,则另一反应物是( )A.FeCl3B.FeCl2C.SD.HCl












