将Cu投入足量的FeCl3的水溶液中 两者发生反应的化学方程式如下:2FeCl3+Cu═2FeCl2
| 将Cu投入足量的FeCl3的水溶液中,两者发生反应的化学方程式如下: 2FeCl3+Cu═2FeCl2+CuCl2 (1)请用双线桥法标出电子转移的方向和数目. (2)在该反应中,氧化剂是______,氧化产物是______. (3)当有0.3mol电子发生转移时,发生反应的Cu的质量为______g. (4)请将以上反应改写为离子方程式______. |
参考解答
(1)化合价升高元素是Cu,失电子,化合价降低元素是Fe,得到电子,化合价升高数=化合价降低数=转移电子数=2,双线桥法,电子转移的方向和数目如下: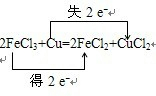 ,故答案为:  ; (2)化合价降低元素Fe元素所在的反应物FeCl3是氧化剂,对应产物FeCl2是还原产物,化合价升高元素Cu所在的反应物是还原剂,对应产物CuCl2 是氧化产物,故答案为:FeCl3;CuCl2; (3)根据方程式当有2mol电子发生转移时,发生反应的Cu的物质的量是1mol,当有0.3mol电子发生转移时,发生反应的 Cu的物质的量是0.15mol,质量是0.15mol×64g/mol=9.6g,故答案为:9.6; (4)反应2FeCl3+Cu=2FeCl2+CuCl2改为离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+. |
相似问题
在某体系内有反应物和生成物5种物质:H2S S FeCl3 FeCl2 HCl.已知H2S为反应物
在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知H2S为反应物,则另一反应物是( )A.FeCl3B.FeCl2C.SD.HCl
实现下列变化 一定要加入氧化剂的是( )A.HCl→Cl2B.Na2SO3→SO2C.HCl→H2
实现下列变化,一定要加入氧化剂的是( )A.HCl→Cl2B.Na2SO3→SO2C.HCl→H2D.HNO3→NO
.用KMnO4氧化密度为1.19g/cm3 溶质的质量分数为36.5%的 盐酸.反应方程式如下:2K
用KMnO4氧化密度为1 19g cm3,溶质的质量分数为36 5%的盐酸.反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O(1)用双线桥法标出上述反应电子得
下列叙述中正确的是( )A.已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+1
下列叙述中正确的是( )A.已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂得到11mole-B.向NaClO溶液中通入少量SO2
下列叙述中 正确的是( )A.含金属元素的离子一定都是阳离子B.在氧化还原反应中 非金属一定是氧化
下列叙述中,正确的是( )A.含金属元素的离子一定都是阳离子B.在氧化还原反应中,非金属一定是氧化剂C.某元素从化合态变为游离态时,该元素一定被












