.用KMnO4氧化密度为1.19g/cm3 溶质的质量分数为36.5%的 盐酸.反应方程式如下:2K
| .用KMnO4氧化密度为1.19g/cm3,溶质的质量分数为36.5%的 盐酸.反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O (1)用双线桥法标出上述反应电子得失数目. (2)求所用盐酸的物质的量浓度. (3)15.8gKMnO4能使多少克HCl发生上述反应?产生的Cl2在标准状况下的体积为多少? |
参考解答
| (1)反应中高锰酸钾为氧化剂,浓盐酸为还原剂,Mn元素的化合价+7→+2,和Cl元素的化合价-1→0,反应中氧化剂和还原剂得失电子数目相等, 答:双线桥法标出反应中电子得失数目为 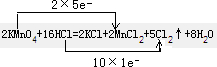 ; (2)c(HCl)=
答:所用盐酸的物质的量浓度为11.9mol?L-1; (3)设15.8gKMnO4能同xgHCl发生反应,生成标准状况下yLCl2. 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 2×158 g 16×36.5 g 5×22.4 L 15.8 g x g y L 则 x=
y=
答:15.8gKMnO4能使29.2克HCl发生上述反应;产生的Cl2在标准状况下的体积为5.6L. |
相似问题
下列叙述中正确的是( )A.已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+1
下列叙述中正确的是( )A.已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂得到11mole-B.向NaClO溶液中通入少量SO2
下列叙述中 正确的是( )A.含金属元素的离子一定都是阳离子B.在氧化还原反应中 非金属一定是氧化
下列叙述中,正确的是( )A.含金属元素的离子一定都是阳离子B.在氧化还原反应中,非金属一定是氧化剂C.某元素从化合态变为游离态时,该元素一定被
下列化学反应中 属于化合反应 但不属于氧化还原反应的是( )A.2CO+O2 点燃 . 2CO2B
下列化学反应中,属于化合反应,但不属于氧化还原反应的是( )A.2CO+O2点燃 2CO2B.Na2O+H2O=2NaOHC.2H2O通电 2H2↑+O2↑D.2H2O+2Na2O2=4NaOH+O2↑
2010年10月1日下午18时59分57秒 中国探月工程先导星“嫦娥二号”在西昌点火升空 准确入轨.
2010年10月1日下午18时59分57秒,中国探月工程先导星“嫦娥二号”在西昌点火升空,准确入轨.月球上有着非常丰富的钛铁矿(主要成分是FeTiO3)资源.已知
NaCl是一种化工原料 可以制备一系列物质(见图).下列说法正确的是( )A.25℃ NaHCO3
NaCl是一种化工原料,可以制备一系列物质(见图).下列说法正确的是( )A.25℃,NaHCO3在水中的溶解度比Na2CO3的大B.常温下干燥的Cl2能用钢瓶贮存












