重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂 工业上常用铬铁矿(主要成份为FeO?Cr2
重铬酸钾(K2Cr2O7)是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO?Cr2O3)为原料生产.实验室模拟工业生产如图: 请回答下列问题: (1)①中发生的主要反应为:FeO?Cr2O3+NaOH+KClO3
则氧化剂是______(写化学式);Na2CrO4的系数是______. (2)在反应器①中,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,其中氧化铝与碳酸钠加热反应的化学方程式为______;NaFeO2能强烈水解,在操作②生成沉淀而除去,该反应的离子方程式为______. (3)操作③调pH目的是将SiO32-和AlO2-转化为沉淀而除去,这两种沉淀的化学式为______. (4)称取重铬酸钾(K2Cr2O7式量为294)试样m g配成VmL溶液,取出V1 mL于锥形瓶中,加入适量的稀H2SO4和足量碘化钾,放于暗处5min,然后加入100mL水,同时加入3mL淀粉溶液作指示剂,用c mol?L-1Na2S2O3标准溶液滴定(设杂质不反应),共用去Na2S2O3标准溶液V2mL,则所得产品中重铬酸钾纯度的代数式为______(不必化简,相关反应为:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62- ) |
参考解答
(1)根据反应的元素化合价变化可知,反应中Cl元素的化合价由+5价降到-1价,反应中得电子,所以KClO3为反应中的氧化剂,根据氧化还原反应中氧化剂和还原剂得失电子数目相等可写出反应的化学方程式为6FeO?Cr2O3+24NaOH+7KClO3
(2)Al2O3与纯碱反应转变为可溶性盐,生成NaAlO2,反应的化学方程式为Al2O3+Na2CO3
故答案为:Al2O3+Na2CO3
(3)由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O 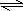 HSiO3-+OH-、HSiO3-+H2O 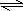 H2SiO3+OH-、AlO2-+2H2O 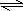 Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀, 故答案为:H2SiO3、Al(OH)3; (4)由反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;I2+2S2O32-=2I-+S4O62-可得反应的关系式为Cr2O72-~3I2~6S2O32-,根据关系式计算. Cr2O72-~3I2~6S2O32- 1mol 3mol 6mol n cV2×10-3mol n=
故答案为:
|
相似问题
溴化碘(IBr)等卤素互化物的化学性质很像卤素的单质 能与大多数金属 非金属化合生成卤化物 如IBr
溴化碘(IBr)等卤素互化物的化学性质很像卤素的单质,能与大多数金属、非金属化合生成卤化物,如IBr能与水发生以下反应:IBr+H2O═HBr+HIO,下列有关IBr
下列反应既属于氧化还原反应 又是吸热反应的是( )A.锌粒与稀硫酸的反应B.灼热的木炭与CO2的反
下列反应既属于氧化还原反应,又是吸热反应的是( )A.锌粒与稀硫酸的反应B.灼热的木炭与CO2的反应C.甲烷在空气中燃烧的反应D.Ba(OH)2?8H2O晶体
高铁酸钾(K2FeO4)是一种新型 高效 多功能水处理剂.下列反应可制取K2FeO4:2Fe(OH)
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH0-30℃ 2K2FeO4+6KCl+8H2O对于该反应,下列说法正确
已知反应:2H2CrO4+3H2O2═2Cr(OH)3+3O2↑+2H2O该反应中H2O2只发生如下
已知反应:2H2CrO4+3H2O2═2Cr(OH)3+3O2↑+2H2O该反应中H2O2只发生如下变化过程:H2O2→O2(1)该反应中的还原剂是______(2)用单线桥法表示反应中电
铬是人体必需元素 如含量不足会影响糖类和脂类的代谢 过高则会引起急性中毒.有关含铬化合物的相互转化关
铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下回答下列问题:(1)上述转化关系中属于












