铬是人体必需元素 如含量不足会影响糖类和脂类的代谢 过高则会引起急性中毒.有关含铬化合物的相互转化关
铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒.有关含铬化合物的相互转化关系如下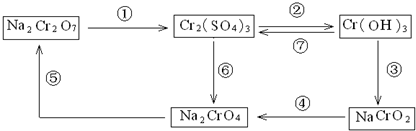 回答下列问题: (1)上述转化关系中属于氧化还原反应的是______(填编号). (2)反应⑤是可逆反应,向黄色的Na2CrO4溶液中加入稀硫酸,溶液逐渐变成橙色,写出该反应的离子方程式______. (3)由图示信息可知,有一种含铬化合物显两性,写出该化合物与NaOH溶液反应的离子方程式:______. (4)已知Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液,首先生成的沉淀是______. (5)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,其原理是以碳作阴极,铁作阳极,电解含NaCl、Cr2O72-的酸性废水. 写出电极反应和溶液中进行的反应的离子方程式: 阳极______;阴极______;溶液中______. |
参考解答
| (1)结合图中的转化关系,有元素化合价变化的反应是①④⑥,均属于氧化还原反应,故答案为:①④⑥; (2)根据图中的转化关系⑤,可知铬酸根在酸性环境下可以变成重铬酸根,黄色溶液逐渐变成橙色,实质是:2CrO42-+2H+ 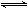 Cr2O72-+H2O,故答案为:2CrO42-+2H+ 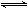 Cr2O72-+H2O; (3)根据图示转化关系③⑦,可以知道Cr(OH)3既能和强酸反应又能和强碱反应,和强碱反应的实质是:Cr(OH)3+OH-=CrO2-+2H2O,故答案为:Cr(OH)3+OH-=CrO2-+2H2O; (4)Ag2CrO4和AgCl的Ksp分别为9.0×10-12、1.56×10-10,向含有相同浓度的Na2CrO4和NaCl的混合溶液中逐滴加入硝酸银溶液, 设Na2CrO4和NaCl的浓度都为1mol/L,Ag2CrO4沉淀时需要的c(Ag+)=
(5)在电解池中,阳极是活泼金属铁电极时,则电极本身失去电子,即Fe-2e-=Fe2+,根据放电顺序阴极上是电解质中氢离子得电子的反应,即2H++2e=H2↑,重铬酸根具有强氧化性,能将生成的亚铁离子氧化为三价,即6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,故答案为:Fe-2e-=Fe2+;2H++2e=H2↑;6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O. |
相似问题
已知Hg2+与I-离子易形成[HgI4]2-离子.CuI可用于监测空气中是否含有汞蒸气:4CuI(白
已知Hg2+与I-离子易形成[HgI4]2-离子.CuI可用于监测空气中是否含有汞蒸气:4CuI(白色)+Hg=Cu2[HgI4](亮黄色)+2Cu.下列关于该化学方程式的说法错误
亚硝酸(HNO2)及其钠盐参加反应时既可作氧化剂又可作还原剂.当它们作还原剂时 生成的含氮产物可能是
亚硝酸(HNO2)及其钠盐参加反应时既可作氧化剂又可作还原剂.当它们作还原剂时,生成的含氮产物可能是( )A.NOB.N2C.NO2D.NH3
分类是学习和研究化学的一种常用科学方法 下列分类合理的是( )A.根据反应是否有电子转移将化学反应
分类是学习和研究化学的一种常用科学方法,下列分类合理的是( )A.根据反应是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应B.根据是否
下列反应既是氧化还原反应 又是放热反应的是( )A.铝片与稀硫酸反应B.Ba(OH)2?8H2O与
下列反应既是氧化还原反应,又是放热反应的是( )A.铝片与稀硫酸反应B.Ba(OH)2?8H2O与NH4Cl反应C.灼热的炭与二氧化碳反应D.氢氧化钠与盐酸的中和反应
(1)铁元素在人体中是以离子形式存在的 人体中经常进行的相互转化 在A过程中 Fe2+做______
(1)铁元素在人体中是以离子形式存在的,人体中经常进行的相互转化,在A过程中,Fe2+做______剂,在B过程中,Fe3+体现______性;“如果服用维生素C,可












