化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。(1)催化
化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。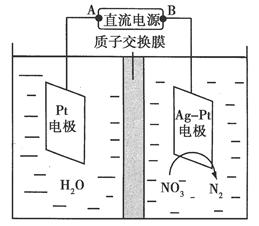 (1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行10 min,溶液的pH由7变为12。 ①N2的结构式为________。 ②上述反应离子方程式为____________________,其平均反应速率v(NO3-)为________mol·L-1·min-1。 ③还原过程中可生成中间产物NO2-,写出3种促进NO2-水解的方法________。 (2)电化学降解NO3-的原理如图所示。 ①电源正极为________(填“A”或“B”),阴极反应式为______________。 ②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为________g。 |
参考解答
(1)①N≡N ②2NO3-+5H2 N2+2OH-+4H2O 0.001 ③加酸,升高温度,加水 N2+2OH-+4H2O 0.001 ③加酸,升高温度,加水(2)①A 2NO3-+6H2O+10e-=N2↑+12OH- ②14.4 点拨:知识:氧化还原反应方程式、电极反应方程式的书写;电极名称的判断、根据电极反应式计算等。能力:全面考查学生运用所学的氧化还原反应原理、电化学原理分析问题和解决问题的能力,对化学计算的能力也进行了考查。试题难度:较难。 |
| 根据溶液的氧化还原反应规律及题意书写离子方程式,根据电极上发生的反应类型判断电极名称,根据电极反应式及质子的移动方向分析溶液的质量变化。 (1)①N2电子式为:N??N:,结构式为N≡N。②反应中碱性增强,故应有OH-生成,根据得失电子守恒有:5H2+2NO3-——N2+OH-,据电荷守恒有:5H2+2NO3-——N2+2OH-,最后由元素守恒得5H2+2NO3-  N2+2OH-+4H2O。③水解的离子方程式为NO2-+H2O N2+2OH-+4H2O。③水解的离子方程式为NO2-+H2O HNO2+OH-,据“越热越水解、越稀越水解”,可知加热或加水稀释能促进水解;另外,降低生成物浓度,也可促进水解。 HNO2+OH-,据“越热越水解、越稀越水解”,可知加热或加水稀释能促进水解;另外,降低生成物浓度,也可促进水解。(2)①NO3-生成N2发生了还原反应,应在电解池的阴极发生,故A为原电池的正极;阴极发生还原反应,故电极反应式为2NO3-+6H2O+10e-=N2↑+12OH-。由电极反应式可知,通过2 mol电子,溶液减少的质量为5.6 g(N2),同时有2 mol H+通过质子交换膜进入右侧,故右侧溶液减少3.6 g。 ②正极发生的反应为4OH--4e-=O2↑+2H2O,每通过2 mol电子,生成16 g O2,同时有2 mol H+通过质子交换膜进入右侧,使左侧溶液质量减少18 g,故两侧溶液减少的质量差为14.4 g。 |
相似问题
已知:将Cl2通人适量KOH溶液 产物中可能有KC1 KClO KC1O3 且的值与温度高低有关。当
已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是()A.若某温度下,反应后
下列关于氧化还原反应的说法中正确的是[ ]A.氧化还原反应前后元素化合价有升降B.氧化还原反
下列关于氧化还原反应的说法中正确的是[ ]A.氧化还原反应前后元素化合价有升降B.氧化还原反应前后一定有氧的得失C.氧化还原反应前后一定有电子得失
火法炼铜首先要焙烧黄铜矿 反应为:2CuFeS2+O2→Cu2S+2FeS+SO2 则下列说法正确
火法炼铜首先要焙烧黄铜矿,反应为:2CuFeS2+O2→Cu2S+2FeS+SO2则下列说法正确的是A.CuFeS2仅作还原剂,硫元素被氧化B.每生成1mol Cu2S,有4 mol硫被
高铁酸钾K2FeO4是一种新型 高效 氧化性比Cl2更强的水处理剂 工业上通常用下列反应先制得高铁酸
高铁酸钾K2FeO4是一种新型、高效、氧化性比Cl2更强的水处理剂,工业上通常用下列反应先制得高铁酸钠:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,然后
(14分)X Y Z W P为短周期的主族元素 其原子序数依次增大。Y Z W P位于同一周期。X
(14分)X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大。Y、Z、W、P位于同一周期。X 元素形成的单质是自然界中含量最多的气体,1mol Y的单质分












