(14分)X Y Z W P为短周期的主族元素 其原子序数依次增大。Y Z W P位于同一周期。X
| (14分)X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大。Y、Z、W、P位于同一周期。X 元素形成的单质是自然界中含量最多的气体,1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L。W的原子最外层电子数与核外电子总数之比为3:8,X的原子序数是Z的原子序数的一半。 (1)Y在周期表中的位置是________;X的氢化物与P的氢化物接近时的现象是_________。 (2)W与P可形成原子个数比为1:2的化合物,其电子式为__________。 (3)Y与P形成的化合物溶液显____性;用离子反应方程式表示显这种性质的原因________________。 (4)Z、W、P三种元素的气态氢化物稳定性由高到低的顺序是______________________(填化学式)。 (5)X的三氟化物是微电子工业中优良的等离子刻蚀气体,但在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色。写出此三氟化物与水反应的化学反应方程式_____,若0.6mol X的三氟化物完全与水反应,则转移的电子总数约为_________个。 |
参考解答
(1)第三周期第ⅢA族;产生大量白烟 (2)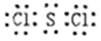 (3)酸;Al3++3H2O  Al(OH)3+3H+ (4)HCl H2S SiH4 Al(OH)3+3H+ (4)HCl H2S SiH4(5)3NF3+5H2O═2NO↑+HNO3+9HF;2.408×1023 |
试题分析:X、Y、Z、W、P为短周期的主族元素,其原子序数依次增大,Y、Z、W、P位于同一周期,X元素形成的单质是自然界中含量最多的气体,则X是N元素;1mol Y的单质分别与足量盐酸和氢氧化钠溶液反应生成的气体在标况下均为33.6L,能和盐酸、氢氧化钠溶液反应且放出气体的物质只有Al,所以Y是Al元素;W的原子最外层电子数与核外电子总数之比为3:8,W的原子序数大于13,且为短周期元素,所以其最外层电子数与其核外电子总数分别是6、16,则W是S元素;X的原子序数是Z的原子序数的一半,所以Z是Si元素,P为短周期主族元素,且原子序数大于16,所以P是Cl元素。 (1)铝元素的原子序数是16,在周期表中的位置是第三周期第ⅢA族;氨气与氯化氢混合迅速反应生成氯化铵,产生大量白烟。 (2)S与Cl可形成原子个数比为1:2的化合物为SCl2,每个氯原子形成1个共用电子对、硫原子形成2个共用电子对,所以其电子式为  。 。(3)Y与P形成的化合物是氯化铝,其溶液显酸性,是由于铝离子水解导致的,离子方程式为Al3++3H2O  Al(OH)3+3H+。 Al(OH)3+3H+。(4)元素非金属性越强,其氢化物越稳定,同一周期元素中,元素的非金属性随着原子序数的增大而增强,所以其氢化物越稳定,因此Si、S、Cl三种元素的气态氢化物稳定性由高到低的顺序是 HCl>H2S>SiH4。 (5)NCl3在潮湿的环境中能与水发生反应生成无色气体,遇空气变为红棕色,说明生成NO,同时还生成硝酸和氢氟酸,该反应的化学方程式为3NF3+5H2O═2NO↑+HNO3+9HF,根据NCl3与转移电子之间的关系式得,转移电子数=  ×1×(5?3)NA/mol=2.408×1023。 ×1×(5?3)NA/mol=2.408×1023。 |
相似问题
建筑工地常用的NaNO2因外观和食盐相似 又有咸味 容易使人误食中毒。已知NaNO2能发生如下反应:
建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:(1)配平上述反应方程式,将系数填入方框中。(2)上述
有Fe3+ Fe2+ NO3- NH4+ H+和H2O六种微粒 分别属于一个氧化还原反应中的反应物和
有Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述中,不正确的是A.还原产物为NH4+B.氧化剂与还原
(1)氧化还原反应的实质是___________________。(2)铁跟氯气在点燃条件下发生反应
(1)氧化还原反应的实质是___________________。(2)铁跟氯气在点燃条件下发生反应:2Fe+3Cl22FeCl3,其中氯元素的化合价_______(填“升高”或“降低
下列实验过程中 始终无明显现象的是( )A.NO2通入FeSO4溶液中B.CO2通入CaCl2溶液
下列实验过程中,始终无明显现象的是( )A.NO2通入FeSO4溶液中B.CO2通入CaCl2溶液中C.NH3通入AlCl3溶液中D.SO2通入已酸化的Ba(NO3)2溶液中
下列说法正确的是[ ]A. 摩尔是物质的量的单位 B. 氧化还原反应的本质是元素化合价发生了
下列说法正确的是[ ]A 摩尔是物质的量的单位 B 氧化还原反应的本质是元素化合价发生了变化C 熔融状态下或溶液中能导电的物质就是电解质 D 得












