将51.2 g Cu完全溶于适量浓硝酸中 收集到氮的氧化物(含NO NO2)的混合物共0.8 mol
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO3的物质的量为
|
参考解答
| A |
试题分析:纵观反应始终,容易看出只有两种元素的价态有变化,其一是Cu到Cu(NO3)2,每个Cu升2价,失2个电子;另一个是HNO3到NaNO2,每个N降2价,得2个电子。51.2gCu共失电子 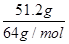 ×2=1.6mol,根据电子转移守恒可知,铜失去的电子等于HNO3到NaNO2得到的电子,所以溶液中n(NaNO2)= ×2=1.6mol,根据电子转移守恒可知,铜失去的电子等于HNO3到NaNO2得到的电子,所以溶液中n(NaNO2)= 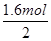 =0.8mol。气体与氢氧化钠反应的盐溶液为NaNO3、NaNO2混合溶液,根据钠离子守恒有n(NaNO3)+n(NaNO2)=n(Na+),所以溶液中n(NaNO3)=n(Na+)-n(NaNO2)=0.5L×2mol/L-0.8mol=0.2mol。选择A选项。 =0.8mol。气体与氢氧化钠反应的盐溶液为NaNO3、NaNO2混合溶液,根据钠离子守恒有n(NaNO3)+n(NaNO2)=n(Na+),所以溶液中n(NaNO3)=n(Na+)-n(NaNO2)=0.5L×2mol/L-0.8mol=0.2mol。选择A选项。 |
相似问题
5NH4NO3=2HNO3+4N2↑+9H2O中 发生氧化反应与发生还原反应的氮原子个数之比是
5NH4NO3=2HNO3+4N2↑+9H2O中,发生氧化反应与发生还原反应的氮原子个数之比是A.1∶3B.5∶3C.5∶8D.5∶4
管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应:(在有水蒸气存在的条件下) 2NH3+
管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应:(在有水蒸气存在的条件下) 2NH3+3Cl2=6HCl+N2下列说法中错误的是()A.用该方法检验
12mL浓度为0.1mol·L-1Na2SO4溶液 恰好与40mL浓度为0.01 mol·L-1K2
12mL浓度为0 1mol·L-1Na2SO4溶液,恰好与40mL浓度为0 01 mol·L-1K2Cr2O7溶液完全反应,则元素Cr在被还原的产物中得化合价是A.0B.+2C. +3D.+6
某温度下 将Cl2通入NaOH溶液中 反应得到NaCl NaClO NaClO3的混合液 经测定Cl
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1∶3,则与溶液反应时被还原的氯元素与被氧化的
在反应2NH3+3Cl2==6HCl+N2中 氧化剂和还原剂的物质的量之比为( )A.1︰3B.
在反应2NH3+3Cl2==6HCl+N2中,氧化剂和还原剂的物质的量之比为()A.1︰3B.1︰2C.2︰3D.3︰2












