如图所示 两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol
如图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )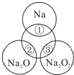
|
参考解答
| C. |
试题分析:A、过氧化钠中阴离子是O2 2﹣,所以阴阳离子数目之比为1:2,故A错误. B、反应①的离子方程式为:2Na+2H2O=2Na++2OH﹣+H2↑,故B错误. C、反应方程式为:2Na2O2+2H2O=4NaOH+O2↑, 2mol 1mol 0.1mol 0.05mol 根据方程式知,最多产生0.05mol O2,故C正确. D、钠、氧化钠、过氧化钠和水反应的方程式分别如下: Na+H2O=NaOH+H2↑,溶液增加的质量=m(Na)﹣m(H2)=2.3g﹣0.1g=2.2g; Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g; Na2O2+H2O=2NaOH+O2↑,溶液增加的质量=m(Na2O2)﹣m(O2)=m(Na2O)=6.2g 所以溶液增加的质量大小顺序为:钠<氧化钠=过氧化钠, 根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠、分别溶于水所得溶液的质量分数分别为: 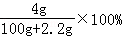 、 、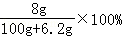 、 、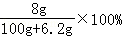 ,所以①、②、③充分反应后所得溶液的质量分数从大到小:①<②=③,故D错误. ,所以①、②、③充分反应后所得溶液的质量分数从大到小:①<②=③,故D错误. |
相似问题
下列关于钠的叙述中 不正确的是A.钠燃烧时发出黄色的火焰B.钠燃烧时生成氧化钠C.钠有很强的还原性D
下列关于钠的叙述中,不正确的是A.钠燃烧时发出黄色的火焰B.钠燃烧时生成氧化钠C.钠有很强的还原性D.钠原子的最外层只有一个电子
保存少量金属钠的方法是 A.放在冰水中B.放在细沙中C.放在水中D.放在煤油中
保存少量金属钠的方法是 A.放在冰水中B.放在细沙中C.放在水中D.放在煤油中
通过对金属钠与水反应现象的观察 不能分析得出的结论是( )A.金属钠熔点低B.金属钠导电性强
通过对金属钠与水反应现象的观察,不能分析得出的结论是()A.金属钠熔点低B.金属钠导电性强C.金属钠密度小D.金属钠化学性质活泼
称取纯Na2CO3 0.53g 用未知浓度的盐酸滴定 恰好完全反应时 用去10mL盐酸。取此盐酸20
称取纯Na2CO3 0 53g,用未知浓度的盐酸滴定,恰好完全反应时,用去10mL盐酸。取此盐酸20mL(稀释到200mL)做如下实验:称取工业烧碱6 25g加水溶解至1L,用
关于钠的叙述中 正确的是A.钠是银白色金属 硬度很大B.将金属钠放在坩埚里用酒精灯加热 生成淡黄色固
关于钠的叙述中,正确的是A.钠是银白色金属,硬度很大B.将金属钠放在坩埚里用酒精灯加热,生成淡黄色固体氧化钠C.金属钠在空气中燃烧,产生黄色火焰,












