如图所示各物质的相互转变中 A是由原子个数比为1:2:4的三种元素组成的化合物 其中某元素的质量分数
如图所示各物质的相互转变中,A是由原子个数比为1:2:4的三种元素组成的化合物,其中某元素的质量分数为50%,J、K是日常食品中的调味剂,J为有机物,相对分子质量为60;常温下,C、D、F、H是气体,E、I是固体单质;反应③④⑤⑥均是工业生产中的重要反应.(反应⑥中生成的水已略去)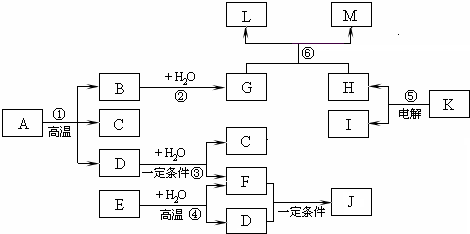 请回答下列问题: (1)写出K的化学式:______;J的结构简式:______. (2)写出反应①的化学方程式:______. (3)写出反应⑥的化学方程式:______. (4)D和F反应生成J,符合绿色化学思想的原因是______. |
参考解答
J、K是日常食品中的调味剂,J为有机物,相对分子质量为60,故J为CH3COOH,由转化关系K
反应⑥是工业生产重要反应,有氯气参加反应,生成三种物质,其中一种是水,考虑漂白粉的制备,物质G可能为Ca(OH)2,B应是CaO; 由转化关系F+D→CH3COOH,可知F与D中共含有C、H、O三种元素,由转化反应④可知,固体E为C单质,故反应④为C+H2O
由反应①可知,A反应生成CaO、CO、CO2,A中含有Ca、C、O三种元素,A不可能是碳酸钙,考虑有机酸的钙盐,A中原子个数比为1:2:4,A可能是CaC2O4,其中O元素的质量分数为50%,符合题意. (1)由上述分析可知,K为NaCl,J为CH3COOH,故答案为:NaCl;CH3COOH; (2)反应①是CaC2O4分解生成CaO、CO2、CO,反应方程式为CaC2O4
故答案为:CaC2O4
(3)反应⑥是氯气与氢氧化钙反应生成氯化钙、次氯酸根与水,反应方程式为:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O, 故答案为:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O; (4)D和F反应生成J的反应为2CO+2H2
|
相似问题
某无色透明溶液可能含有下列离子:K+ Al3+ Fe3+ Ba2+ NO3- SO42- HCO3-
某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:①用蓝色石蕊试纸检测该溶液,试纸显红色;②
如图所示:已知A和E为金属单质 B是化合物且常温下为液态 F为两性化合物.按要求回答下列问题:(1)
如图所示:已知A和E为金属单质,B是化合物且常温下为液态,F为两性化合物.按要求回答下列问题:(1)E在元素周期表中位于第______周期;第______族.(2
下列各组物质中 物质之间通过一步反应就能实现图示变化的是( )物质编号物质转化关系abcd ① F
下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )物质编号物质转化关系abcd① FeCl2FeCl3FeCuCl2②NONO2N2HNO3③Na2ONa2O2NaNaOH④Al
A B C都是由两种元素组成的无机物 它们和单质甲 乙 丙存在如图所示的转化关系(转化过程都不需要使
A、B、C都是由两种元素组成的无机物,它们和单质甲、乙、丙存在如图所示的转化关系(转化过程都不需要使用催化剂).完成下列问题:(1)若甲是常见金属
A J是日常生活中常见的两种金属 这两种金属和NaOH组成原电池 A作负极;F常温下是气体 各物质有
A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去).请回答以下问












