工业上常利用低品位软锰矿浆(主要成分是MnO2)来吸收含SO2的废气 最终制得硫酸锰晶体(MnSO4
工业上常利用低品位软锰矿浆(主要成分是MnO2)来吸收含SO2的废气,最终制得硫酸锰晶体(MnSO4·H2O),其主要流程如下: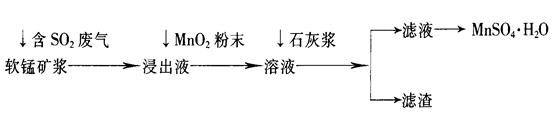 已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
(1)软锰矿浆中通入含SO2废气后,发生主要反应的化学方程式为____________________。 (2)浸出液中加入MnO2粉末的目的是____________;反应的离子方程式是___________________。 (3)溶液中加入石灰浆来调节pH,其作用是_________________;pH应调节的范围是__________。 (4)滤渣的主要成分是________________________________________________(用化学式表示)。 |
参考解答
| (12分,每空2分)(1)SO2+MnO2=MnSO4 (2)将Fe2+氧化为Fe3+;2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O (3)使Fe3+、Al3+完全沉淀;4.7≤pH<8.3 (4)Fe(OH)3、Al(OH)3、CaSO4 |
试题分析:(1)低品位软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,这说明MnO2与SO2发生了氧化还原反应,反应的化学方程式为SO2+MnO2=MnSO4。 (2)杂质离子中Fe2+完全沉淀时的pH大于Mn2+开始沉淀时的pH,所以必须利用其还原性将其氧化成铁离子而除去。由于MnO2具有氧化性,能把亚铁离子氧化生成Fe3+,有关反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。 (3)溶液的杂质离子Fe3+、Al3+阳离子,从图可表以看出,大于4.7可以将Fe3+和Al3+除去,但不能超过8.3,以防止Mn2+也沉淀,所以只要调节pH值在4.7≤pH<8.3间即可。 (4)Fe3+、Al3+等金属阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,同时还生成微溶性的硫酸钙,所以滤渣主要有氢氧化铁、氢氧化铝、硫酸钙,其化学式分别是Fe(OH)3、Al(OH)3、CaSO4。 |
相似问题
做蒸馏实验时用到铁架台和单孔胶塞的个数分别为A.1个和2个B.2个和2个C.2个和3个D.2个和4个
做蒸馏实验时用到铁架台和单孔胶塞的个数分别为A.1个和2个B.2个和2个C.2个和3个D.2个和4个
下列有关实验操作不正确的是( )A.蒸发时用玻璃棒不断搅拌溶液 待出现较多固体时停止加热B.
下列有关实验操作不正确的是()A.蒸发时用玻璃棒不断搅拌溶液,待出现较多固体时停止加热B.将碘水中的碘萃取出来的实验中,萃取剂要求不溶于水,且比
对下列各组物质进行区别的实验方案(见括号内)不妥的是A.溴水和碘水(淀粉溶液)B.硫酸铵与氯化铵(采
对下列各组物质进行区别的实验方案(见括号内)不妥的是A.溴水和碘水(淀粉溶液)B.硫酸铵与氯化铵(采用加碱加热闻其气味的方法)C.NaCl与KCl(采用
Ⅰ某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置 以探究潮湿的Cl2与干燥Na2CO3
Ⅰ某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与干燥Na2CO3 固体反应得到的固体物质的成分。已知:通入一定量的氯气
某工厂用软锰矿(含MnO2约70% 及A12O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO
某工厂用软锰矿(含MnO2约70% 及A12O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料):已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3












