某工厂用软锰矿(含MnO2约70% 及A12O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO
某工厂用软锰矿(含MnO2约70% 及A12O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料):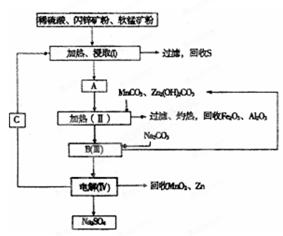 已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。 ②IV中的电解方程式为 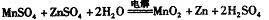 (1)A中属于还原产物的是_____。 (2)加人MnCO3、Zn2(OH)2CO3的作用是_________________;II需要加热的原因是:______ ;C的化学式是_________。 (3)该生产中除得到MnO2和Zn以外,还可得到的副产品是_____。 (4)如果不考虑生产中的损耗,除矿石外,需购买的化工 原料是_______。 (5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进 行的操作有蒸发浓缩、 、过滤、洗涤、干燥等。 (6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是____。 |
参考解答
| (1) MnSO4(2分) (2)增大溶液的pH,使Fe3+和 Al3+生成沉淀 (2分) (3) Fe2O3、Al2O3、S (4) 纯碱、硫酸 (5)降温结晶 、1.03 |
试题分析: (1)在氧化还原反应中,化合价降低元素所在的产物是还原产物;比较信息①,A与软锰矿中元素化合价的变化可知,锰元素化合价从+4价降低为+2价,所以A中还原产物为MnSO4,故答案为:MnSO4; (2)根据框图:向MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液中加入MnCO3、Zn2(OH)2CO3后可以获得氧化铁和氧化铝,所以加入MnCO3、Zn2(OH)2CO3的作用就是调节pH,使Fe3+、Al3+沉淀完全,在加热的环境下,金属阳离子的水解更彻底,更易形成沉淀而分离,根据IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4,可知C为硫酸,故答案为:增大溶液的PH,使Fe3+和Al3+均生成沉淀;促进Fe3+和Al3+的水解;H2SO4; (3)该实验的目的就是制备二氧化锰与锌,因而就需要把氧化铝、铁元素、硫元素除去.根据流程图不难得出该生产中除得到MnO2和Zn以外,还可得到的副产品有硫、氧化铁、氧化铝,故答案为:Fe2O3、Al2O3、S、Na2SO4; (4)根据框图中转化消耗的反应物,如果不考虑生产中的损耗,除矿石外,需购买的化工原料是氢氧化钠和硫酸,故答案为:纯碱和硫酸; (5)据反应MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4可知MnO2、Zn的物质的量之比为1:1,故可设软锰矿、闪锌矿的质量分别为x、y,得0.7x ×87:0.8y×97=1:1,故x:y=1.03,故答案为:1.03. |
相似问题
某校化学小组的同学进行以碳棒为电极电解氯化铜溶液时发现阴极碳棒上除了有红色物质析出外 还有少量白色物
某校化学小组的同学进行以碳棒为电极电解氯化铜溶液时发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出。为探究阴极碳棒上的产物,设计了如下
废易拉罐的成分比较复杂 据查 铝易拉罐各部分成分及含量(质量百分含量)见表: SiFeCuMnMgC
废易拉罐的成分比较复杂,据查,铝易拉罐各部分成分及含量(质量百分含量)见表:SiFeCuMnMgCrZnTiAl罐身 %0 30 70 250 251 0~1 5其余罐盖 %0 20 350 15
可用来鉴别乙烯 四氯化碳 苯的方法是A.磺化反应B.溴水C.液溴D.硝化反应
可用来鉴别乙烯、四氯化碳、苯的方法是A.磺化反应B.溴水C.液溴D.硝化反应
下列除杂质(括号内为杂质)方法不合理的是( )A.Fe2+(Fe3+) 加过量铁粉 过滤B.Mg
下列除杂质(括号内为杂质)方法不合理的是()A.Fe2+(Fe3+),加过量铁粉,过滤B.Mg(Al),加过量NaOH溶液,过滤C.(HCl),过量饱和,洗气D.食
对于某些离子的检验及结论一定正确的是( )A.加入稀盐酸能产生无色气体 一定有CO32—B.加入氯
对于某些离子的检验及结论一定正确的是()A.加入稀盐酸能产生无色气体,一定有CO32—B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有S












