一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物填空和回答下列问题:(1)B物质是
一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物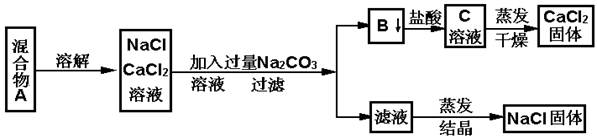 填空和回答下列问题: (1)B物质是 (写化学式) (2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中某一步设计有毛病,这一步的正确设计方案应是 。 (3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是 。 (4)请写出从B到C的离子方程式 。 |
参考解答
| (1)CaCO3; (2)加入适量盐酸至不产生气体 (3)A ; CaCO3+2H+=Ca2++CO2↑+H2O |
试题分析:(1)NaCl和CaCl2两种固体混合物,溶解后加入过量碳酸钠溶液,生成碳酸钙沉淀和氯化钠,过滤后得到的沉淀B为碳酸钙;(2)由于碳酸钠过量,所以滤液中的物质有氯化钠和碳酸钠,因此要得到纯净的氯化钠就需要除去碳酸钠,向滤液中加入适量盐酸至不产生气体,生成氯化钠和水和二氧化碳,蒸发后最后的固体物质是氯化钠;(3)要测定该样品中NaCl和CaCl2的质量比,可称量干燥的碳酸钙的质量,根据反应CaCO3+2H+=Ca2++CO2↑+H2O可计算氯化钙的质量,混合物A的总质量减去氯化钙的质量可得氯化钠的质量;(4)碳酸钙和盐酸发生:CaCO3+2H+=Ca2++CO2↑+H2O,得到氯化钙溶液,经蒸发可得到氯化钙固体。 |
相似问题
下列实验操作 现象和解释都正确的是 选项实验操作现象解释A.向某溶液中加入盐酸产生无色气体溶液中一定
下列实验操作、现象和解释都正确的是 选项实验操作现象解释A.向某溶液中加入盐酸产生无色气体溶液中一定含有CO32?B.新制Fe(OH)2露置于空气中一段时间
过氧化钙晶体(CaO2·8H2O)呈白色 微溶于水 加热至350℃左右开始分解放出氧气。过氧化钙可用
过氧化钙晶体(CaO2·8H2O)呈白色,微溶于水,加热至350℃左右开始分解放出氧气。过氧化钙可用于改善地表水质、处理含重金属粒子废水、应急供氧等。实验
有五瓶失去标签的溶液 它们分别为:①Ba(NO3)2②KCl③NaOH④CuSO4⑤Na2SO4 如
有五瓶失去标签的溶液,它们分别为:①Ba(NO3)2②KCl③NaOH④CuSO4⑤Na2SO4,如果不用其他任何试剂(包括试纸),用最简便的方法将它们一一鉴别开来,则
地球上99%的溴元素存在于海洋中 资料显示海水中溴含量约为66mg·L—1。从海水中提取溴的工业流程
地球上99%的溴元素存在于海洋中,资料显示海水中溴含量约为66mg·L—1。从海水中提取溴的工业流程如下:(1)写出海水淡化的一种方法:。(2)步骤Ⅱ通
检验氯化氢气体中是否混有氯气可采用的方法是A.用干燥的蓝色石蕊试纸B.用干燥的有色布条C.将气体通入
检验氯化氢气体中是否混有氯气可采用的方法是A.用干燥的蓝色石蕊试纸B.用干燥的有色布条C.将气体通入硝酸银溶液D.用湿润的淀粉碘化钾试纸












