过氧化钙晶体(CaO2·8H2O)呈白色 微溶于水 加热至350℃左右开始分解放出氧气。过氧化钙可用
| 过氧化钙晶体(CaO2·8H2O)呈白色,微溶于水,加热至350℃左右开 始分解放出氧气。过氧化钙可用于改善地表水质、处理含重金属粒子废水、应急供 氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再 用纯的碳酸钙制取过氧化钙,其主要流程如下:  回答下列问题: 整个流程中涉及的化学反应属于氧化还原反应的有 个,请写出其中任意一个的离子方程式: ; (2)反应②生成CaO2·8H2O的化学反应方程式为 ; 反应时用冰水冷却的主要原因是 ; (3)将过氧化钙晶体在坩埚中加热并逐渐升高温度。测得样品质量随温度的变化如图曲线所示,则350℃以后所得固体物质的化学式为 。 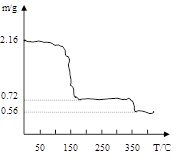 |
参考解答
(1)3FeCO3+10H++NO3-=3Fe3++NO↑+3CO2↑+5H2O (2)CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O+2NH4Cl 防止H2O2分解,提高其利用率或降低CaO2·8H2O溶解度,提高产率 (3)CaO |
试题分析:(1)只有反应①中的FeCO3与硝酸反应是氧化还原反应,反应为 3FeCO3+10H++NO3-=3Fe3++NO↑+3CO2↑+5H2O (2)该反应的反应物为CaCl2、H2O2、NH3,故方程式为CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O+2NH4Cl 因为H2O2受热易分解,故采用冰水冷却的方式防止其分解,提高利用率,同时温度低能较低溶解度,提高产率。 (3)在加热过程中固体中钙元素的量不变,固体由2.16g加热到350℃变为0.56g, n(Ca)='2.16÷216=0.01mol' m(CaO) =0.01×56=0.56g 故该固体为CaO (这样的解法是一种猜测,该题可以先计算失去全部结晶水时质量,再由此计算质量差得出化学式) |
相似问题
有五瓶失去标签的溶液 它们分别为:①Ba(NO3)2②KCl③NaOH④CuSO4⑤Na2SO4 如
有五瓶失去标签的溶液,它们分别为:①Ba(NO3)2②KCl③NaOH④CuSO4⑤Na2SO4,如果不用其他任何试剂(包括试纸),用最简便的方法将它们一一鉴别开来,则
地球上99%的溴元素存在于海洋中 资料显示海水中溴含量约为66mg·L—1。从海水中提取溴的工业流程
地球上99%的溴元素存在于海洋中,资料显示海水中溴含量约为66mg·L—1。从海水中提取溴的工业流程如下:(1)写出海水淡化的一种方法:。(2)步骤Ⅱ通
检验氯化氢气体中是否混有氯气可采用的方法是A.用干燥的蓝色石蕊试纸B.用干燥的有色布条C.将气体通入
检验氯化氢气体中是否混有氯气可采用的方法是A.用干燥的蓝色石蕊试纸B.用干燥的有色布条C.将气体通入硝酸银溶液D.用湿润的淀粉碘化钾试纸
除去下列物质中的杂质 所用试剂和方法不正确的是 ( ) 物质杂质除杂质所用试剂和方法AKCl溶
除去下列物质中的杂质,所用试剂和方法不正确的是()物质杂质除杂质所用试剂和方法AKCl溶液I2CCl4,萃取BKNO3K2SO4Ba(NO3)2溶液,过滤CCuCuO[盐酸,过
实验室用固态不纯氯化钠(含少量NH4HCO3和Na2SO4杂质)配制氯化钠溶液。下列操作可供选用:①
实验室用固态不纯氯化钠(含少量NH4HCO3和Na2SO4杂质)配制氯化钠溶液。下列操作可供选用:①逐滴加入稀盐酸,调节pH值为5;②煮沸;③加蒸馏水溶解;④












