大气固氮(闪电时N2转化为NO)和工业固氮(合成氨)是固氮的重要形式。下表列举了不同温度下大气固氮和
大气固氮(闪电时N2转化为NO)和工业固氮(合成氨)是固氮的重要形式。下表列举了不同温度下大气固氮和工业固氮的部分K值(K表示平衡常数):
 氮的另一途径为 。 氮的另一途径为 。(2)根据表中的数据,并结合所学知识分析,下列说法正确的是 。 a.人类大规模模拟大气固氮实际意义很小 b.常温下,大气固氮与工业固氮完成程度相差很大 c.两种固氮都是放热反应 d.在常温下,大气固氮几乎不可能,而工业固氮很容易进行 (3)为研究反应条件的改变对化学平衡移动的影响,将N2和H2在一固定体积的密闭容器中进行反应,得到如下的图像。下列有关条件改变(每次只改变一个条件)的说法,正确的是 。 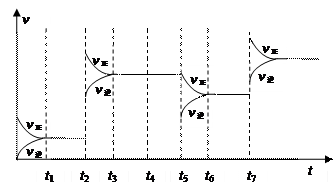 a.t2可能是增加了原料的物质的量 b.t4可能是充入了He气 c.t5是从反应体系中分离出氨气 d.t7时可能是升高温度,使平衡向正反应方向移动 (4)目前工业固氮采用的是哈伯法,即在20~50MPa的高压和500℃左右的  高温下,并用铁触媒作为催化剂。俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)的新催化剂,在常温下合成氨,反应的化学方程式为:N2 +3H2 高温下,并用铁触媒作为催化剂。俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)的新催化剂,在常温下合成氨,反应的化学方程式为:N2 +3H2 2NH3。有关说法正确的是 。 2NH3。有关说法正确的是 。a.新法不需要高温条件,可节约大量能源 b.新法能在常温下进行是因为不需要断裂化学键 c.在相同温度下不同的催化剂其催化活性不同 | |||||||||||||||
参考解答
| (本题8分) (1)把大气中游离态的氮转化为氮的化合物;(1分)生物固氮(1分) (2)a、b(2分,少选得1分,多选或错选0分) (3)b、c(2分,少选得1分,多选或错选0分) (4)a、c(2分,少选得1分,多选或错选0分) |
| 略 |
相似问题
(12分)在一容积为2 L的密闭容器中加入2 molA和3 molB 保持温度为30℃ 在催化剂存在
(12分)在一容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应: ,达到平衡后生成1.2 mol C,此时
(14分)痛风是关节炎反复发作及产生肾结石为特征的一类疾病 关节炎的原因归结于在关节滑液中形成了尿酸
(14分)痛风是关节炎反复发作及产生肾结石为特征的一类疾病,关节炎的原因归结于在关节滑液中形成了尿酸钠(NaUr)晶体,有关平衡如下:① HUr(尿酸,aq
在容积不变的密闭容器中有反应:X(g) + Y(g) z(g) 若Z(g)的物质的量浓度c(Z)与
在容积不变的密闭容器中有反应:X(g) + Y(g) z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态)。则下列说法不
氟化氢气体能以(HF)n形式存在 已知氟化氢气体中存在下面的平衡: H3F33HF (正反应为
氟化氢气体能以(HF)n形式存在,已知氟化氢气体中存在下面的平衡: H3F33HF (正反应为吸热反应) H2F22HF (正反应为吸热反应)则下列叙述中,不正确的是
T ℃时 在1 L的密闭容器中充入2 mol CO2和6 mol H2 一定条件下发生反应:CO2(
T ℃时,在1 L的密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49 0 kJ·mol-1测得H2和CH3OH


 2NO
2NO









