(14分)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法 Cl2 CCl4是常用的氯化剂。如
| (14分)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂。如: Na2O+Cl2=2NaCl+O2 CaO+Cl2=CaCl2+O2 SiO2+2CCl4=SiCl4+2COCl2 Cr2O3+3CCl4=2CrCl3+3COCl2 请回答下列问题: ⑴写出铬的原子结构示意图为 与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有____________(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为________。 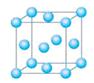 ⑵ CCl4分子中C原子采取 杂化成键。 ⑶ COCl2俗称光气,分子中C原子采取sp2杂化成键。光气分子的结构式是 ,其中碳氧原子之间共价键是 (填序号) a.2个σ键 b.2个π键 c.1个σ键、1个π键 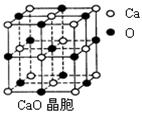 ⑷ CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为 。CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分别为:CaO-3401kJ?mol-1、NaCl-786kJ?mol-1。导致两者晶格能差异的主要原因是 。 |
参考解答
| (14分) ⑴ 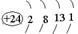 (2分) K、Cu(各1分,多写此格不给分) 4(1分) (2分) K、Cu(各1分,多写此格不给分) 4(1分)⑵ sp3(1分) ⑶ 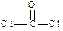 (2分) c(2分) (2分) c(2分) ⑷ 6 (2分) Ca  O晶体中离子的电 O晶体中离子的电 荷数大于NaCl (2分) 荷数大于NaCl (2分) |
| 略 |
相似问题
离子键的强弱主要决定于离子半径和离子的电荷值。一般规律是:离子半径越小 电荷值越大 则离子键越强。试
离子键的强弱主要决定于离子半径和离子的电荷值。一般规律是:离子半径越小,电荷值越大,则离子键越强。试分析:①K2O②CaO③MgO 的离子键由强到弱的顺
下列物质属于分子晶体的化合物是( )A.石英B.碘C.干冰D.食盐
下列物质属于分子晶体的化合物是( )A.石英B.碘C.干冰D.食盐
能与NaOH溶液反应的属于原子晶体的化合物是( )A.金刚石B.石墨C.石英(SiO2)D.
能与NaOH溶液反应的属于原子晶体的化合物是()A.金刚石B.石墨C.石英(SiO2)D.CO2
关于晶体的自范性 下列叙述正确的是( )A.破损的晶体能够在固态时自动变成规则的多面体B.缺角的氯
关于晶体的自范性,下列叙述正确的是( )A.破损的晶体能够在固态时自动变成规则的多面体B.缺角的氯化钠晶体在饱和NaCl溶液中慢慢变为完美的立方体块C
一种离子晶体的晶胞如右图。其中阳离子A以表示 阴离子B以表示。(1)每个晶胞种含A离子的数目为___
一种离子晶体的晶胞如右图。其中阳离子A以表示,阴离子B以表示。(1)每个晶胞种含A离子的数目为________,含B离子数目为________。(2)若A的核外电子排












