金属镁有许多重要的用途 法国化学家维多克·格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝
金属镁有许多重要的用途,法国化学家维多克·格利雅因发明了在有机合成方面用途广泛的格利雅试剂而荣获诺贝尔化学奖,格利雅试剂的结构简式可表示为RMgX,它是金属镁和卤代烃反应的产物,简称格氏试剂,它在醚的稀溶液中以单体形式存在,并与二分子醚络合,在浓溶液中以二聚体存在,结构如下图: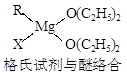 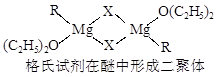 ①标出格氏试剂 中的配位键 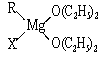 ②下列比较中正确的是 A.金属键的强弱:Mg>Al B.基态原子第一电离能:Mg>Al C.金属性:Mg>Al D.晶格能:KCl>NaCl E.电负性:Mg>Al F.硬度:Mg>Al  ③二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是 。 A.苯与B3N3H6互为等电子体 www.kB.甲醛、苯分子中碳原子均采用sp2杂化 C.苯、二氧化碳是非极性分子,水和甲醛是极性分子 D.水的沸点比甲醛高得多,是因为水分子间能形成氢键 |
参考解答
①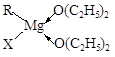 ②AB ③ABCD ②AB ③ABCD |
试题分析:①乙醚中氧原子含有孤对电子,所以形成的配位健是 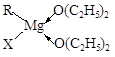 。 。②镁的金属性强于铝的,A正确,C不正确;镁原子的3s轨道电子处于全充满状态,稳定性强,所以第一电离能大于铝的,B正确;钠离子半径小于钾离子半径,所以氯化钠的晶格能大于氯化钾的晶格能,D不正确;非金属性越强,电负性越大,铝的电负性大于镁的,E不正确;铝离子半径小于钠离子半径,所以铝的硬度大于镁的,F不正确,答案选AB。 ③原子数和价电子数分别都相等的是等电子体,A正确;甲醛和苯都是平面型结构,所以碳原子是sp2杂化,B正确;同样分析选项CD都是正确的,答案选ABCD。 点评:该题是高考中的常见考点,属于基础性试题的考查。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和应试能力,提高学生灵活运用基础知识解决实际问题的能力。 |
相似问题
下列有关金属的说法正确的是( )A.金属原子的核外电子在金属晶体中都是自由电子B.镁型和铜型的原
下列有关金属的说法正确的是()A.金属原子的核外电子在金属晶体中都是自由电子B.镁型和铜型的原子堆积方式空间利用率最高C.金属原子在化学变化中失去
下面有关晶体的叙述中 正确的是( )A.分子晶体中一定存在共价键B.第ⅦA族氢化物随相对分子质量
下面有关晶体的叙述中,正确的是()A.分子晶体中一定存在共价键B.第ⅦA族氢化物随相对分子质量增加,熔沸点逐渐升高,HF沸点最低C.离子晶体在熔化时
天然气既是重要的能源 也是重要的化工原料 其主要成分是甲烷。(1)甲烷在一定条件下可生成:A.碳正离
天然气既是重要的能源,也是重要的化工原料,其主要成分是甲烷。(1)甲烷在一定条件下可生成:A.碳正离子(CH3-) B.碳负离子(CH3-)C.
(2分)金属晶体的最密堆积的配位数是 空间利用率是 。
(2分)金属晶体的最密堆积的配位数是,空间利用率是。
(15分)氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物 经过一系列反应可以得到BF3和
(15分)氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:请回答下列问题:(1)由B2O3制备BF3












