(15分)氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物 经过一系列反应可以得到BF3和
(15分)氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示: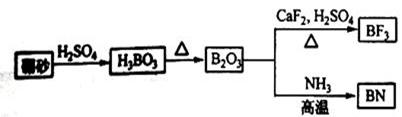 请回答下列问题: (1)由B2O3制备BF3、BN的化学方程式依次是 ; ; (2)基态B原子的电子排布图为 ; BN中B元素的化合价为 ; (3)在BF3分子中,F—B—F的键角是 ,B原子的杂化轨道类型为 ; (4)已知: BF3 + NaF(过量)= NaBF4;化合物NaBF4含有的化学键类型为 ;BF4-中F—B—F的键角是 ,B原子的杂化轨道类型为 ,BF4-的立体构型为 ; (5)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的相互作用为 ,层间作用力为 。含1 mol BN的六方氮化硼晶体中含B-N的个数为 NA。 |
参考解答
1)(4分)B2O3+3CaF2+3H2SO4 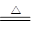 2BF3↑+3CaSO4 +3H2O ; 2BF3↑+3CaSO4 +3H2O ;B2O3+2NH3 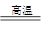 2BN+3H2O; 2BN+3H2O;(2)(2分) 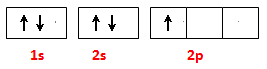 ; +3 ; +3 (3)(2分)1200 , sp2; (4)(4分)离子键、极性共价键、配位键 ; 109028, , sp3 ,正四面体; (5)(3 分) 极性共价键 ,范德华力 ; 3。 |
| (1)根据反应物和生成物可知,方程式分别是 B2O3+3CaF2+3H2SO4 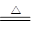 2BF3↑+3CaSO4 +3H2O、B2O3+2NH3 2BF3↑+3CaSO4 +3H2O、B2O3+2NH3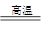 2BN+3H2O。 2BN+3H2O。(2)根据构造原理可写出基态B原子的电子排布图。氮元素是第ⅤA,最低价是-3价,所以B元素的化合价是+3价。 (3)在BF3分子中,中心原子B原子没有孤对电子,所以其结构是平面三角形,键角是120°。其中B原子的杂化轨道类型为sp2杂化。 (4)化合物NaBF4属于钠盐,因此含有的的化学键类型为离子键和极性键。由于氟原子含有孤对电子,所以还含有配位键。同样中心原子B原子没有孤对电子,所以其结构是正四面体形,键角是109028,, B原子是sp3杂化。 (5)层内B原子与N原子之间的相互作用为极性键,而层与层之间是分子间作用力。因为B原子能形成3个B-N键,所以含1 mol BN的六方氮化硼晶体中含B-N的个数为3NA。 |
相似问题
下列说法正确的是( )A.某晶体固态不导电 水溶液能导电说明该晶体是离子晶体B.原子晶体的原子间只
下列说法正确的是()A.某晶体固态不导电,水溶液能导电说明该晶体是离子晶体B.原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力。C.区分晶
A B C D E都是周期表中前四周期的元素。已知A原子的p轨道中有3个未成对电子 其气态氢化物在水
A、B、C、D、E都是周期表中前四周期的元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B 的基态
(8分) 氮化硅是一种高温陶瓷材料 它的硬度大 熔点高 化学性质稳定。工业上普遍采用高纯硅与纯氮在1
(8分)、氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅。(1)根据性质,推测氮化
在下列有关晶体的叙述中错误的是 A.离子晶体的构成微粒是离子B.原子晶体的熔沸点一般很高C.金属晶体
在下列有关晶体的叙述中错误的是 A.离子晶体的构成微粒是离子B.原子晶体的熔沸点一般很高C.金属晶体的熔沸点均很高D.稀有气体的原子能形成分子晶体
某物质有以下性质:①是电解质 ②溶解时有化学键的破坏 ③熔化时没有化学键的破坏 则该物质固态时属于A
某物质有以下性质:①是电解质,②溶解时有化学键的破坏,③熔化时没有化学键的破坏,则该物质固态时属于A.原子晶体B.离子晶体C.分子晶体D.金属晶体












