A B C D E都是周期表中前四周期的元素。已知A原子的p轨道中有3个未成对电子 其气态氢化物在水
| A、B、C、D、E都是周期表中前四周期的元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区。C元素原子的外围电子层排布式为nsn—1npn—1。 D原子M能层为全充满状态,且最外层无成对电子,E为第四周期未成对电子数最多的元素。请回答下列问题: (1)写出E基态原子的电子排布式 ;E在周期表中的位置是 ,其基态原子有 种能量不同的电子。 (2)某同学根据上述信息,推断B的核外电子排布如右图所示, 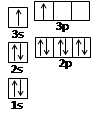 该同学所画的电子排布图违背了 。 (3)已知A和C形成的化合物X中每个原子的最外层均为8电子稳定结构,则X的化学式为 ,X是一种超硬物质,耐磨损、抗腐蚀能力强,推测X的晶体类型为 。 (4)B的单质与A的最高价含氧酸的稀溶液反应,能将A还原至最低价态,写出该反应的化学方程式 。 (5) 已知D晶体的粒子堆积方式为面心立方最密堆积,若该晶体中一个晶胞的边长为a cm,则D晶体的密度为 g/cm3(写出含a的表达式,用NA表示阿伏加德罗常数的值)。若D的原子半径为r ,则在D晶胞中用r表示出这种堆积模型的空间利用率为 。(列式表示,不需化简) |
参考解答
| (1)1s22s22p63s23p63d54s1 第4周期第ⅥB族 7 (2) 能量最低原理 (3)Si3N4 原子晶体 (4)4Mg + 10HNO3= 4Mg(NO3)2 + NH4NO3 + 3H2O (5)256/a3NA 4× 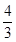 r3/ (2 r3/ (2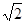 r)3 r)3 |
试题分析:A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,这说明A应该是氮元素。B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区,所以B是镁元素。C元素原子的外围电子层排布式为nsn—1npn—1,其中能=2,则n=3,所以C是硅元素。D原子M能层为全充满状态,且最外层无成对电子,这说明D是铜元素。E为第四周期未成对电子数最多的元素,所以E是铬6元素。 (1)根据构造原理可知,铬元素基态原子的电子排布式1s22s22p63s23p63d54s1 。铬的原子序数是24,位于周期表的第4周期第ⅥB族。由于同一能层中不同能级的能量也是不相同的,所以铬也是元素基态原子有7种能量不同的电子。 (2)根据轨道表达式可知,同学所画的电子排布图违背了能量最低原理。 (3)A和C形成的化合物X中每个原子的最外层均为8电子稳定结构,由于Si位于第ⅣA族,氮元素位于第ⅤA族,则X的化学式Si3N4。根据X的物理性质可知形成的晶体是原子晶体。 (4)氮元素的最低价是-3价,所以其还原产物是硝酸铵,则反应的化学方程式是4Mg + 10HNO3= 4Mg(NO3)2 + NH4NO3 + 3H2O。 (4)在立方体顶点的微粒为8个晶胞共有,在面心的为2个晶胞共有,则微粒数为:8×1/8 + 6×1/2 = 4。该晶体中一个晶胞的边长为a cm,则 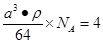 ,解得密度=256/a3NA。 ,解得密度=256/a3NA。根据晶胞结构可知,4r= 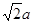 ,解得a= ,解得a=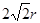 则晶胞立方体的体积为 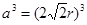 晶胞中4个金属原子的体积为 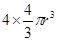 所以此晶胞中原子空间占有率是4× 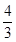 r3/(2 r3/(2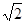 r)3 r)3点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的应试能力和逻辑推理能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。 |
相似问题
(8分) 氮化硅是一种高温陶瓷材料 它的硬度大 熔点高 化学性质稳定。工业上普遍采用高纯硅与纯氮在1
(8分)、氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅。(1)根据性质,推测氮化
在下列有关晶体的叙述中错误的是 A.离子晶体的构成微粒是离子B.原子晶体的熔沸点一般很高C.金属晶体
在下列有关晶体的叙述中错误的是 A.离子晶体的构成微粒是离子B.原子晶体的熔沸点一般很高C.金属晶体的熔沸点均很高D.稀有气体的原子能形成分子晶体
某物质有以下性质:①是电解质 ②溶解时有化学键的破坏 ③熔化时没有化学键的破坏 则该物质固态时属于A
某物质有以下性质:①是电解质,②溶解时有化学键的破坏,③熔化时没有化学键的破坏,则该物质固态时属于A.原子晶体B.离子晶体C.分子晶体D.金属晶体
已知氯化钠的摩尔质量是58.5g/mol 密度是2.2g/ cm 3 则氯化钠晶体中相邻的钠离子核间
已知氯化钠的摩尔质量是58 5g mol,密度是2 2g cm 3,则氯化钠晶体中相邻的钠离子核间距离的数值最接近于A 4 0×10-8cmB 3 5×10-8cmC 3 0×10-8cmD 5 0×10-8cm
下列说法中不正确的是A.在金刚石晶体最小的碳原子环上有6个碳原子B.在氯化铯晶体中每一个Cs+周围与
下列说法中不正确的是A.在金刚石晶体最小的碳原子环上有6个碳原子B.在氯化铯晶体中每一个Cs+周围与其等距离且最近的Cl-有8个C.在氯化钠晶体中每一个Na












