通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱 也可
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
请回答下列问题: (1)比较下列两组物质的熔点高低(填“>”或“<”)。SiC____________Si;SiCl4____________SiO2。 (2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。 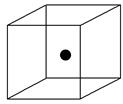 (3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)  Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol-1。 Si(s)+4HCl(g)该反应的反应热ΔH=________ kJ·mol-1。 |
参考解答
| (1)> < (2)如下图 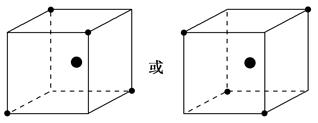 (3)236 |
| (1)SiC和晶体Si皆为原子晶体,由于碳化硅晶体中的Si—C键的键能大于硅晶体中Si—Si键的键能,故SiC的熔点比Si高;SiCl4为分子晶体,SiO2为原子晶体,故SiCl4的熔点比SiO2低。 (2)晶体硅的结构与金刚石相似,每个硅原子都被相邻的4个硅原子包围,这4个硅原子位于四面体的四个顶点上,被包围的硅原子处于正四面体的中心。 (3)根据题目所给反应式,需要断裂的旧化学键键能之和为4×360 kJ·mol-1+2×436 kJ·mol-1=2 312 kJ·mol-1,形成的新化学键键能之和为4×431 kJ·mol-1+2×176 kJ·mol-1=2 076 kJ·mol-1,所以ΔH=236 kJ·mol-1。 |
相似问题
下列数据是对应物质的熔点(单位:℃) Na2O
下列数据是对应物质的熔点(单位:℃)Na2O NaClAlF3AlCl3BCl3Al2O3CO2SiO29208011291190-1072073-571723据此做出的下列判断中,正确的是
(共7分)Mn Fe均为第四周期过渡元素 回答下列问题:(1)Mn元素价电子的电子排布式为_____
(共7分)Mn、Fe均为第四周期过渡元素,回答下列问题:(1)Mn元素价电子的电子排布式为_______ _ (2)Fe原子或离子外围有较多能量相近的空轨道而能与一些
下列晶体分类中正确的一组是( ) 离子晶体原子晶体分子晶体ANaOHArSO2BH2SO4石墨SC
下列晶体分类中正确的一组是( )离子晶体原子晶体分子晶体ANaOHArSO2BH2SO4石墨SCCH3COONaSiO2CO2DBa(OH)2金刚石玻璃
下列固体属于离子晶体的是A.石墨B.氯化钠C.干冰D.铁
下列固体属于离子晶体的是A.石墨B.氯化钠C.干冰D.铁
下列化学式能真实表示物质分子组成的是 (
下列化学式能真实表示物质分子组成的是()①NaOH②SiO2③SO3④He⑤P ⑥Na2O2A.②③⑤B.③⑤C.③④D.③④⑤












