(共7分)Mn Fe均为第四周期过渡元素 回答下列问题:(1)Mn元素价电子的电子排布式为_____
| (共7分)Mn、Fe均为第四周期过渡元素,回答下列问题: (1)Mn元素价电子的电子排布式为_______ _ (2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。 ①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是________。 ②六氰合亚铁离子[Fe(CN)]中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN-互为等电子体的单质分子的结构式______ (3)三氯化铁常温下为固体,熔点282 ℃,沸点315 ℃,在300 ℃以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为________。 (4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。 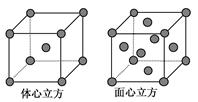 |
参考解答
| (1)3d54s2 (2)①具有孤对电子 ②sp N≡N(3)分子晶体 (4)2:1 (2分) |
| (1)锰的原子序数是25,根据构造原理可写出锰元素价电子的电子排布式为3d54s2。 (2)要形成配位键就必须有能提供孤对电子的配体;CN-的构型是直线型,属于sp杂化。价电子和原子数分别都相同的分子是价电子,所以和CN-互为等电子体的单质分子是氮气,结构式为N≡N。 (3)氯化铁的熔沸点比较低,且易溶于水或有机溶剂等,说明应该是分子晶体。 (4)面心立方晶胞和体心立方晶胞中含有的原子个数分别为8×1/8+6×1/2=4,8×1/8+1=2,所以个数之比是2︰1。 |
相似问题
下列晶体分类中正确的一组是( ) 离子晶体原子晶体分子晶体ANaOHArSO2BH2SO4石墨SC
下列晶体分类中正确的一组是( )离子晶体原子晶体分子晶体ANaOHArSO2BH2SO4石墨SCCH3COONaSiO2CO2DBa(OH)2金刚石玻璃
下列固体属于离子晶体的是A.石墨B.氯化钠C.干冰D.铁
下列固体属于离子晶体的是A.石墨B.氯化钠C.干冰D.铁
下列化学式能真实表示物质分子组成的是 (
下列化学式能真实表示物质分子组成的是()①NaOH②SiO2③SO3④He⑤P ⑥Na2O2A.②③⑤B.③⑤C.③④D.③④⑤
如图所示的是某原子晶体A空间结构的一个单元 A与某物质B反应生成C 其实质是每个A—A键中插入一个B
如图所示的是某原子晶体A空间结构的一个单元,A与某物质B反应生成C,其实质是每个A—A键中插入一个B原子,则C物质的化学式为A.ABB.AB4C.AB2D.A2B5
下列物质中一定含有离子的是( )A.晶体氯B.铝粉C.液态氯化氢D.次氯酸钙
下列物质中一定含有离子的是()A.晶体氯B.铝粉C.液态氯化氢D.次氯酸钙












