下表为周期表的一部分 其中的编号代表对应的元素。试填空。(1)写出上表中元素I的基态原子的电子排布式
下表为周期表的一部分,其中的编号代表对应的元素。 试填空。 (1)写出上表中元素I的基态原子的电子排布式和价层电子排布图: 。 元素C、D、E、F的第一电离能由大到小的顺序是 (用元素符号表示)。 (2)元素A分别与C、D、E形成最简单的常见化合物分子甲、乙和丙。下列有关叙述不正确的有 。 A.甲、乙和丙分子的空间构型分别为正四面体形、三角锥形、V形 B.甲、乙和丙分子中,中心原子均采取sp3的杂化方式 C.三种分子中键角由大到小的顺序是丙>乙>甲 D.甲、乙和丙分子均为由极性键构成的极性分子 (3)由元素J、C、E组成一种化学式为J(CE)5的配位化合物,该物质常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂。据此可判断: ①该化合物的晶体类型为 。 ②该化合物的晶体中存在的作用力有 。 A.离子键 B.极性键 C.非极性键 D.范德华力 E.氢键 F.配位键 ③根据共价键理论和等电子体理论分析,CE分子中σ键与π键的数目比为 。 (4)在测定A与F形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是 。 (5)某些不同族元素的性质也有一定的相似性,如表中元素G与元素B,原因是 。 |
参考解答
(1)1s22s22p63s23p63d54s1(或[Ar3d54s1) 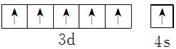 F>N>O>C F>N>O>C(2)CD (3)①分子晶体 ②BDF ③1∶2 (4)氟化氢气体中存在因氢键而相互缔合形成的缔合分子(HF)n (5)Be与Al在元素周期表中位于对角线的位置 |
根据这几种元素在周期表中的位置推知:A为H(氢),B为Be,C为C(碳),D为N,E为O,F为F(氟),G为Al,H为Cl,I为Cr,J为Fe,(1)Cr元素基态原子的电子排布式为1s22s22p63s23p63d54s1或[Ar3d54s1,其价层电子排布图为 ,一般来说,同周期元素从左到右第一电离能逐渐增大,但N元素原子2p轨道上电子达到半充满,故其第一电离能要大于O的第一电离能,因此这四种元素的第一电离能由大到小的顺序为F(氟)>N>O>C(碳)。(2)甲、乙、丙分别为CH4、NH3、H2O,这三种分子的中心原子均采取sp3的杂化方式,它们的空间构型分别为正四面体形、三角锥形、V形,CH4分子中的键角为109°28′,而NH3分子和H2O分子上有未成键的孤电子对;孤对电子越多,排斥力越大,键角越小,所以键角顺序为H2O<NH3<CH4,故A项、B项正确,C项错误;这三种分子中,CH4为非极性分子,NH3、H2O均为极性分子,D项错误。(3)由该化合物的熔沸点可判断它为分子晶体,分子晶体中均存在范德华力,由该分子的结构可以看出其晶体中还存在极性键和配位键;CO分子和N2分子互为等电子体,故CO分子的结构与N2类似,为C≡O,因此CO分子中σ键和π键的个数比为1∶2。(4)A与F形成的化合物为HF,它的分子间存在的氢键会使HF相互结合形成(HF)n,从而使得测的相对分子质量偏高。(5)Be和Al在元素周期表中位于对角线的位置,因此它们的有些性质是相似的。 ,一般来说,同周期元素从左到右第一电离能逐渐增大,但N元素原子2p轨道上电子达到半充满,故其第一电离能要大于O的第一电离能,因此这四种元素的第一电离能由大到小的顺序为F(氟)>N>O>C(碳)。(2)甲、乙、丙分别为CH4、NH3、H2O,这三种分子的中心原子均采取sp3的杂化方式,它们的空间构型分别为正四面体形、三角锥形、V形,CH4分子中的键角为109°28′,而NH3分子和H2O分子上有未成键的孤电子对;孤对电子越多,排斥力越大,键角越小,所以键角顺序为H2O<NH3<CH4,故A项、B项正确,C项错误;这三种分子中,CH4为非极性分子,NH3、H2O均为极性分子,D项错误。(3)由该化合物的熔沸点可判断它为分子晶体,分子晶体中均存在范德华力,由该分子的结构可以看出其晶体中还存在极性键和配位键;CO分子和N2分子互为等电子体,故CO分子的结构与N2类似,为C≡O,因此CO分子中σ键和π键的个数比为1∶2。(4)A与F形成的化合物为HF,它的分子间存在的氢键会使HF相互结合形成(HF)n,从而使得测的相对分子质量偏高。(5)Be和Al在元素周期表中位于对角线的位置,因此它们的有些性质是相似的。 |
相似问题
下列说法正确的是A.离子化合物中一定含有金属元素B.构成分子晶体的微粒中一定含有共价键C.原子晶体熔
下列说法正确的是A.离子化合物中一定含有金属元素B.构成分子晶体的微粒中一定含有共价键C.原子晶体熔化要破坏共价键D.只有离子化合物中才存在离子
下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是( )A.食盐和蔗糖熔化B.钠
下列每组物质发生状态变化所克服的粒子间的相互作用属于同种类型的是()A.食盐和蔗糖熔化B.钠和硫熔化C.碘和干冰升华D.二氧化硅和氧化钠熔化
(1)在下列物质①NH3 ②BF3 ③HCl ④SO3 属于非极性分子的是(填番号)________
(1)在下列物质①NH3、②BF3、③HCl、④SO3,属于非极性分子的是(填番号)________________。(2)试比较含氧酸的酸性强弱(填“>”、“<”或“=”):
B元素与最活泼的非金属元素F形成化合物BF3 检测发现BF3分子中三根B—F键的键长相等且
B元素与最活泼的非金属元素F形成化合物BF3,检测发现BF3分子中三根B­—F键的键长相等且键角也相等,可以判断出BF3分子为__________分子(选填“极性
最近科学家发现了一种新分子 它具有空心的类似足球的结构 分子式为C60 下列说法正确的是A.C60是
最近科学家发现了一种新分子,它具有空心的类似足球的结构,分子式为C60,下列说法正确的是A.C60是一种新型的化合物B.C60和石墨都是碳的同素异形体C.C












