在常见的非金属及其化合物中:(1)晶体硅的导电性介于导体和绝缘体之间 是良好的 材料;
| 在常见的非金属及其化合物中: (1)晶体硅的导电性介于导体和绝缘体之间,是良好的 材料;硅酸钠水溶液俗称为 ,是制备硅胶和木材防火剂的原料;陶瓷、 、水泥等硅酸盐产品是使用量最大的无机非金属材料。 (2)氯元素是重要的“成盐元素”,将氯气通入NaOH溶液中可以得到漂白液,反应的离子方程式是 ;漂白液有效成分的化学式为 。 (3)水是常见的非金属元素化合物,请按要求写出下列水参加的反应的化学方程式。 ①水只作氧化剂: ②NO2气体通入水中: ③水既作氧化剂又作还原剂: |
参考解答
| (1)半导体 水玻璃 玻璃 (2)Cl2+2OH-=Cl-+ClO-+H2O NaClO (3)①2Na+2H2O 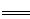 2NaOH+H2↑ 等 2NaOH+H2↑ 等 ②3NO2+H2O  2HNO3+NO 2HNO3+NO③2H2O  2H2↑+O2↑ 2H2↑+O2↑ |
试题分析:(1)晶体硅的导电性介于导体和绝缘体之间,是良好的半导体材料,硅酸钠水溶液俗 称为水玻璃,陶瓷、玻璃、水泥是使用量最大的无机非金属材料; (2)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠、水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,其中漂白液有效成分是次氯酸钠,化学式为NaClO; (3)①水只作氧化剂:钠与水的反应、铁与水蒸气的反应、碳与水蒸气的反应等, ②NO2气体通入水中生成硝酸和一氧化氮,化学方程式为3NO2+H2O  2HNO3+NO, 2HNO3+NO,③水既作氧化剂又作还原剂,水的电解,2H2O  2H2↑+O2↑ 2H2↑+O2↑ |
相似问题
氯碱工业是用电解饱和食盐水的方法来制取NaOH Cl2和H2 并以它们为原料生产一系列化工产品.总反
氯碱工业是用电解饱和食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品.总反应为:2NaCl+2H2O电解 2NaOH+Cl2↑+H2↑(1)用单线桥表
已知氮元素有许多化合价 其化合价有一3 0 +1 +2 +3 +4 +5(1)下表是硝酸与某种金属M
已知氮元素有许多化合价,其化合价有一3、0、+1、+2、+3、+4、+5(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系:金属锌与某浓度的硝酸
将11.9 g由Mg Al Fe组成的合金溶于足量的NaOH溶液中 合金质量减少了2.7 g。另取等
将11 9 g由Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2 7 g。另取等质量的合金溶于过量稀硝酸中,生成了6 72 L NO(标准状况下),向
单质硫在KOH的热溶液中发生岐化反应:3 S + 6 KOH2 K2S + K2SO3 + 3 H2
单质硫在KOH的热溶液中发生岐化反应:3 S + 6 KOH2 K2S + K2SO3 + 3 H2O若硫过量,进一步生成K2Sx(x ≤ 5)和K2S2O3。将0 08 mol单质硫与
下列有关氧化还原反应叙述正确的是[ ]A.氧化还原反应的本质是化合价发生变化B.有单质产生的
下列有关氧化还原反应叙述正确的是[ ]A 氧化还原反应的本质是化合价发生变化B 有单质产生的分解反应一定是氧化还原反应 C 非金属单质在反应中只可作氧












