人类与食盐关系密切 食盐在老百姓生活和现代社会的工农业生产中均有重要作用.粗盐中含有Ca2+ Mg2
| 人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用.粗盐中含有Ca2+、Mg2+、SO42-以及泥沙等杂质,请回答粗盐提纯的有关问题: (1)为了除去粗盐中的泥沙,可采取的提纯实验操作方法的名称是______. (2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤______.请补全实验步骤,并回答步骤③的目的是______. (3)2010年7月26日,卫生部公布了《食用盐碘含量》的征求意见稿,面向社会征求意见.对于食用盐中碘含量平均水平的规定有所降低.食盐中添加的是KIO3.可用下列反应来检验食盐中是否含KIO3:KIO3+KI+H2SO4-I2+K2SO4+H2O (未配平).请配平该反应并表示出电子转移的方向和数目______;为了获取反应后溶液中的I2,可采取的实验操作方法的名称是______. |
参考解答
| (1)可以先将粗盐和其中的泥沙溶解于水,氯化钠是易溶于水的,而泥沙是难溶于水的,而固体和液体的分离可以采用过滤方法,故答案为:溶解、过滤; (2)在粗盐提纯时,要在最后一步加入盐酸,除去过量的氢氧根离子和碳酸根离子,加入碳酸钠的目的是除去钙离子和多余的钡离子,故答案为:加适量盐酸; 除去Ca2+及过量Ba2+; (3)根据电子守恒和原子守恒来配平方程式,在氧化还原反应KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O中,化合价升高值=化合价降低值=转移电子数=6,电子转移情况如下: 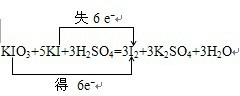 ,碘单质从碘水中提取可以采用萃取分液法,利用四氯化碳来萃取,然后根据四氯化碳和碘的沸点的不同来分离, 故答案为:  ;萃取、蒸馏. |
相似问题
在反应3BrF3 + 5H2O = HBrO3 + Br2 +9HF + O2↑中 若有5molH2
在反应3BrF3 + 5H2O = HBrO3 + Br2 +9HF + O2↑中,若有5molH2O做还原剂,被水还原的BrF3的物质的量为()A.3molB.10 3molC.7 5molD.无法计算
下将Cl2通入KOH溶液里 反应后得到KCl KClO KClO3的混合溶液 经测定ClO-与ClO
下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧
(1)用“单线桥”表示下列反应电子转移的方向和数目:2KMnO4+16HCl=2KCl+2MnCl2
(1)用“单线桥”表示下列反应电子转移的方向和数目:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中物质的氧化性:KMnO4______Cl2(填“>、<、=”);
随着材料科学的发展 金属钒及其化合物得到了越来越广泛的应用 并被誉为“合金的维生素”.已知钒的原子序
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.已知钒的原子序数为23,相对原子质量为51,试回答下列问题:
亚硫酸钠和碘酸钾在酸性溶液中发生以下发应: Na2SO3+ KIO3+ H2SO4 → __Na2S
亚硫酸钠和碘酸钾在酸性溶液中发生以下发应:Na2SO3+KIO3+H2SO4 → __Na2SO4 +K2SO4+I2 +(1)配平上面的方程式,在横线上填入系数,在方框填上反应












