(1)用“单线桥”表示下列反应电子转移的方向和数目:2KMnO4+16HCl=2KCl+2MnCl2
| (1)用“单线桥”表示下列反应电子转移的方向和数目: 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 反应中物质的氧化性:KMnO4______Cl2(填“>、<、=”);氧化产物与还原产物的物质的量之比为______. (2)配平下列氧化还原反应方程式: ______KMnO4+______H2S+______H2SO4(稀)--______K2SO4+______MnSO4+______S↓+______H2O (3)Cl2是一种黄绿色有毒气体,化工厂可用浓氨水来检验有毒气体Cl2是否泄漏,有关反应的化学方程式为:3Cl2+8NH3=6NH4Cl+N2 若反应中NH3消耗6.8g,则转移电子个数为______. |
参考解答
| (1)反应中,化合价升高元素是氯元素,失电子,化合价降低元素是锰元素,得到电子,化合价升高数=化合价降低数=转移电子数=10,单线桥表示反应中电子转移的方向和数目为: , 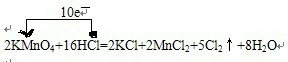 ,反应中化合价升高元素是盐酸中的氯元素,所以盐酸是还原剂,高锰酸钾是氧化剂,氯气是氧化产物,氧化剂的氧化性强于氧化产物的氧化性,所以物质的氧化性:KMnO4>Cl2,氧化产物是氯气,还原产物是氯化锰,它们的物质的量之比为5:2, ,反应中化合价升高元素是盐酸中的氯元素,所以盐酸是还原剂,高锰酸钾是氧化剂,氯气是氧化产物,氧化剂的氧化性强于氧化产物的氧化性,所以物质的氧化性:KMnO4>Cl2,氧化产物是氯气,还原产物是氯化锰,它们的物质的量之比为5:2,故答案为: 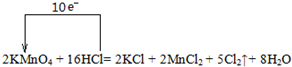 ;>;5:2; ;>;5:2;(2)在反应中,Mn元素化合价降低了5价,硫元素的化合价升高了2价,根据电子守恒,所以锰元素的前边系数都是2,硫化氢前边系数是5,根据原子守恒,硫酸钾的前边系数是1,硫酸锰前边系数是2,根据S守恒,硫酸前边系数是3,水前边系数为8,即2KMnO4+5H2S+3H2SO4(稀)═1K2SO4+2MnSO4+5S↓+8H2O, 故答案为:2、5、3、1、2、5、8; (3)反应3Cl2+8NH3=6NH4Cl+N2中,化合价升高数=化合价降低数=转移电子数=6,即反应中NH3消耗8mol,则转移电子6mol,当反应中NH3消耗6.8g,则转移电子个数为0.3NA或1.806×1023个,故答案为:0.3 NA或1.806×1023个. |
相似问题
随着材料科学的发展 金属钒及其化合物得到了越来越广泛的应用 并被誉为“合金的维生素”.已知钒的原子序
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.已知钒的原子序数为23,相对原子质量为51,试回答下列问题:
亚硫酸钠和碘酸钾在酸性溶液中发生以下发应: Na2SO3+ KIO3+ H2SO4 → __Na2S
亚硫酸钠和碘酸钾在酸性溶液中发生以下发应:Na2SO3+KIO3+H2SO4 → __Na2SO4 +K2SO4+I2 +(1)配平上面的方程式,在横线上填入系数,在方框填上反应
在一定条件下 RO3n-与氟气可发生如下反应:RO3n- + F2 + 2OH- = RO4- +
在一定条件下,RO3n-与氟气可发生如下反应:RO3n- + F2 + 2OH- = RO4- + 2F- + H2O 从而可知在RO3n-中,元素R的化合价是 [ ]A、+4 B、+5 C、+6 D、+7
(10分)根据反应8NH3+3Cl2=6NH4Cl+N2回答下列问题。(1)氧化剂
(10分)根据反应8NH3+3Cl2=6NH4Cl+N2回答下列问题。(1)氧化剂,还原剂(2)用双线桥法标出反应中电子转移情况(3)氧化剂与氧化产物的质量比_________
某种矿石中铁元素以氧化物FemOn形式存在(矿石中杂质不与酸反应) 现进行如下实验:将少量铁矿石样品
某种矿石中铁元素以氧化物FemOn形式存在(矿石中杂质不与酸反应),现进行如下实验:将少量铁矿石样品粉碎,称取25 0g样品于烧杯中,加入稀H2SO4充分溶解












