硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌 菱锌矿的主要成分是ZnCO3 并含少量的
硫酸锌可作为食品锌强化剂的原料.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程示意如下: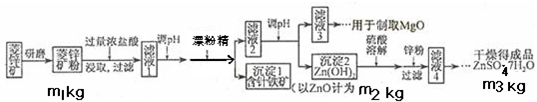 (1)将菱锌矿研磨成粉的目的是_______,滤液1后两步操作的目是:______. (2)完成加漂粉精反应的离子方程式: ______Fe(OH)2+____________+____________→______Fe(OH)3+______Cl- (3)针铁矿的组成元素是Fe、O和H,化学式量为89,化学式是______. (4)为了了解如何调节滤液2的PH,请写出两个你认为需要查阅的数据 ______,______(用文字叙述) (5)“滤液4”之后的操作依次为______、______、过滤,洗涤,干燥. (6)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于______. |
参考解答
| (1)将菱锌矿研磨成粉可以增加反应时的接触面积,使得反应更加充分,滤液1中混有Fe3+和Fe2+,调节PH,加入漂白精的目的是将Fe2+氧化为Fe3+,生成Fe(OH)3沉淀除去,故答案为:增大反应物接触面积或增大反应速率或使反应更充分;除去含铁杂质; (2)流程中“氧化除铁”是加入漂白粉,方程式后面产物中又有氯离子,可知氧化剂是ClO-,观察方程式前后可以推出还要加入水分子, 故答案为:2Fe(OH)2+ClO-+H2O═2Fe(OH)3+Cl-; (3)化学式量为89,组成元素是Fe、O、H,其中铁的相对原子量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,所以可能的组成为FeO(OH), 故答案为:FeO(OH)(或其它合理答案); (4)调节滤液2的PH要想生成Zn(OH)2沉淀而不生成Mg(OH)2,必须知道Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH,故答案为:Mg(OH)2开始沉淀时的pH、Zn(OH)2开始沉淀时的pH,Mg(OH)2沉淀完全时的pH、Zn(OH)2沉淀完全时的pH(任写两个即可); (5))“滤液4”之后的操作目的是得到纯净的固体,应将溶液蒸发、结晶、过滤后洗涤并干燥,故答案为:蒸发浓缩、冷却结晶; (6)设碳酸锌的质量为m,利用关系式法计算: ZnCO3----ZnO 125 81 m m2 ZnCO3 的质量为
ZnCO3 的质量分数为
|
相似问题
KClO3和浓盐酸在一定温度下反应会生成黄绿色的 易爆物二氧化氯。其变化可表示为:2KClO3+4H
KClO3和浓盐酸在一定温度下反应会生成黄绿色的 易爆物二氧化氯。其变化可表示为:2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。 (1)请分析该反应中电子转
KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯 其变化可表述为(1)请配平上述化学
KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为(1)请配平上述化学方程式(计量数填入框内)(2)浓盐酸在反应中显示出
5NH4NO3=4N2↑+2HNO3+9H2O的反应中 氧化产物和还原产物的物质的量比为( )A.3
5NH4NO3=4N2↑+2HNO3+9H2O的反应中,氧化产物和还原产物的物质的量比为()A.3:5B.5:3C.4:2D.2:4
已知在稀硫酸中 KBrO3和KI能发生以下反应(均未配平):BrO3-+H++I-→I03-+Br2
已知在稀硫酸中,KBrO3和KI能发生以下反应(均未配平):BrO3-+H++I-→I03-+Br2+H20I03-+H++Br-→Br2+I2+H20(1)试比较在酸性条件下BrO3-、Br2、I03-、I
(15分)在航天发射时 肼(N2H4)及其衍生物常用作火箭推进剂。⑴液态肼作火箭燃料时 与液态N2O
(15分)在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。⑴液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1g肼充分反应后生成气态












