已知将浓盐酸滴入高锰酸钾溶液中 产生黄绿色气体 而溶液的紫红色褪去.现有一个氧化还原反应的体系中共有
| 已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去.现有一个氧化还原反应的体系中共有3Cl、Cl2、H2SO4、H2O、3MnO4、MnSO4、32SO4七种物质. (1)该反应中,化合价升高的反应物是______. (2)写出一个包含上述七种物质的氧化还原反应方程式:______. (3)上述反应中,1mol氧化剂在反应中得到______mol电子. (4)如图:将浓盐酸滴入高锰酸钾固体中,制取适量黄绿色气体的简易装置,请回答下列有关问题:装置C、D的作用分别是:C______;D______. (多)某浓盐酸的密度l.1d8g?cm-3,该盐酸的物质的量浓度C1=13.13mol?L-1,溶质HCl的质量分数为W1=4中%.则质量分数W2=2中%的盐酸其物质的量浓度C2______(填大于、等于或小于)6.多6多mol?L-1. 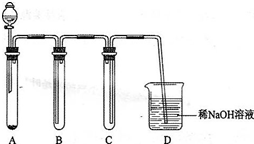 |
参考解答
| (三)在给出的物质中由Cl元素的化合价变化,则氧化反应为KCl→Cl2,所以该反应中反应物化合价升高的是 KCl,故答案为:KCl; (2)由题意可知,高锰酸钾具有氧化性,则还原反应为KMnO4→MnSO4,则在给出的物质中由Cl元素的化合价变化,则氧化反应为KCl→Cl2, 则反应为KMnO4+KCl+H2SO4→MnSO4+K2SO4+Cl2↑+H2O,由电子守恒及原子守恒可得配平后的化学反应为2KMnO4+三0KCl+8H2SO4═2MnSO4+6K2SO4+5Cl2↑+8H2O, 故答案为:2KMnO4+三0KCl+8H2SO4═2MnSO4+6K2SO4+5Cl2↑+8H2O; (3)反应中氧化剂为KMnO4,还原剂为KCl,根据化合价的变化KMnO4~MnSO4~5e-;三mol氧化剂KMnO4在反应中得到电子5mol,故答案为:5; (4)将浓盐酸滴入高锰酸钾固体中,制取适量黄绿色气体的简易装置中,B是收集氯气的装置,氯气比空气重,导气管长进短出向上排气法收集气体,C装置导气管短进长出,是为了防止D中的溶液因压强变化发生倒吸的装置,顺利收集氯气起到安全作用;由于氯气是有毒气体不能排放到大气中,需要尾气吸收装置; 故答案为:安全作用防止D中液体倒吸入集气管B装置中;尾气吸收,防止有毒气体氯气扩散到空气中污染空气; (5)浓盐酸的密度l.三98g?cm-3,该盐酸的物质的量浓度C三=三3.三3mol?L-三,溶质HCl的质量分数为c三=40%,C三=
C2=
C2=
因盐酸密度大于三,所以浓度越大,密度越大,因此ρ<三.98;C2<
故答案为:右于; |
相似问题
依据硫元素的化合价判断 下列物质中只具有还原性的是( )A.H2SB.SO2C.SD.H2SO4
依据硫元素的化合价判断,下列物质中只具有还原性的是( )A.H2SB.SO2C.SD.H2SO4
一个完整的氧化还原反应方程式可以拆开 写成两个“半反应式” 一个是“氧化反应式” 一个是“还原反应式
一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应
已知实验室制氯气的化学方程式为:MnO2+4HCl (浓)=MnCl2+Cl2↑+2H2O 其中:(
已知实验室制氯气的化学方程式为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O,其中:(1)MnO2中Mn元素被______.(2)HCl中氯原子______(填“得到”或“失去”
X Y Z是原子序数依次递增的短周期元素 3种元素的原子核外电子数之和与Ca2+的核外电子数相等 X
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层
关于反应 MnO2+4HCl(浓)=MnCl2+Cl2+2H2O 的说法中 正确的是( )A.氧化
关于反应MnO2+4HCl(浓)=MnCl2+Cl2+2H2O的说法中,正确的是( )A.氧化剂:MnO2,氧化产物是:MnCl2B.还原剂:MnO2,还原产物是:MnCl2C.氧化剂:












