短周期元素A B C D E的原子序数依次增大 A元素阳离子的原子核外没有电子 B是空气中含量最多的
| 短周期元素A、B、C、D、E的原子序数依次增大,A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质。 (1)画出D元素的原子结构示意图 。C、D、E的简单离子半径由小到大的顺序 (用离子符号表示)。 (2)写出元素E在周期表中的位置 。 (3)工业上常用A和B的单质合成一种常见气体,检验该气体的常用方法是 。 (4)D2C2与H2O反应的化学方程式是 ,D2C2与CuSO4溶液反应的现象是 。 (5)由元素A、B、C按原子个数比4:2:3形成的化合物,写出其电离方程式: 。 |
参考解答
| (1) , Al3+<Na+<O2- (2)第三周期,ⅢA族 (3)用润湿的红色石蕊试纸接近该气体,若试纸变红,证明氨气存在 (4)2Na2O2 + 2H2O =' 4NaOH' + O2↑ 、 产生蓝色沉淀并有气泡放出 (5)NH4NO3=NH4+ + NO3- |
试题分析:A元素阳离子的原子核外没有电子,所以A是H元素;B是空气中含量最多的元素,所以B是N元素;C元素原子最外层电子数是其电子层数的三倍,则C只能是2层电子,最外层6个电子,则C是O元素;C与D可形成两种常见的离子化合物,则D是Na元素;工业上常用电解C与E的化合物来制备E单质,工业常电解氧化铝来制备铝单质,所以E是Al元素。 (1)Na的原子结构示意图为 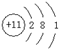 氧离子、钠离子与铝离子的核外电子排布相同,核电荷数越少,半径越大,所以C、D、E的简单离子半径由小到大的顺序是Al3+<Na+<O2- (2)Al元素位于元素周期表的第三周期,ⅢA族; (3)A和B的单质合成一种常见气体,该气体是氨气,检验氨气的方法是用润湿的红色石蕊试纸接近该气体,若试纸变红,证明氨气存在; (4)过氧化钠与H2O反应的化学方程式是2Na2O2 + 2H2O =' 4NaOH' + O2↑;过氧化钠与水反应的产物又与CuSO4溶液反应,所以有气体放出,同时溶液中产生蓝色沉淀; (5)由元素H、N、O按原子个数比4:2:3形成的化合物是硝酸铵,硝酸铵是强电解质,完全电离,电离方程式为NH4NO3=NH4+ + NO3- |
相似问题
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物 经过一系列反应可以得到BF3和BN 请回
氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,请回答下列问题(1)基态B原子的电子排布式为_________;B
甲乙两种非金属 能说明甲的非金属性一定比乙强的是A.甲与金属反应时得电子的数目比乙多B.甲单质的熔沸
甲乙两种非金属,能说明甲的非金属性一定比乙强的是A.甲与金属反应时得电子的数目比乙多B.甲单质的熔沸点比乙的低C.甲的氧化物对应的水化物酸性比乙强
X Y Z L M N六种元素的原子序数依次增大。X Y Z L是组成蛋白质的基础元素 M是短周期原
X、Y、Z、L、M、N六种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是短周期原子半径最大的元素,N是地壳中含量最高的金属元素。用化学
A B C D为原子序数依次增大的四种短周期元素 其性质或结构信息如下表:试回答以下问题(1)B在周
A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:试回答以下问题(1)B在周期表中的位置是。B的氢化物与E的氢化物比较,沸点较
四种短周期元素W X Y Z的原子序数依次递增 X的一种单质能在空气中自燃。电解含有Y和Z的阴离子的
四种短周期元素W、X、Y、Z的原子序数依次递增,X的一种单质能在空气中自燃。电解含有Y和Z的阴离子的混合溶液时,在阳极Y离子先失去电子。W和Z同主族。对












