X Y Z L M N六种元素的原子序数依次增大。X Y Z L是组成蛋白质的基础元素 M是短周期原
| X、Y、Z、L、M、N六种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是短周期原子半径最大的元素,N是地壳中含量最高的金属元素。 用化学用语回答下列问题: (1) M在元素周期表中的位置为 ;六种元素的原子半径从大到小的顺序是 (2)Z、X两元素按原子数目比l∶3构成分子A, A的电子式为 ,Y、L两元素按原子数目比l∶2构成分子B,B中所含的化学键类型为 。 (3)硒(se)是人体必需的微量元素,已知非金属性:34Se<L。请结合原子结构解释原因 。 (4)用Y、L、M构成的正盐溶液可以清除油污,请结合离子方程式以及必要的文字解释原因 。 (5)用石墨作电极,NCl3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出电解熔融Q制取N的电极方程式:阳极: ;阴极: 。 |
参考解答
| (1)第三周期、第ⅠA族(1分);Na>Al>C>N>O>H(2分) (2) 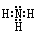 (1分),极性共价键(1分) (1分),极性共价键(1分)(3)O和Se同族,原子半径依次增大,导致得电子能力减弱,所以非金属性减弱。(2分) (4) CO32- + H2O 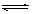 HCO3- +OH-,碳酸钠溶液水解显碱性,促使油脂在碱性条件下水解从而溶解。(2分) HCO3- +OH-,碳酸钠溶液水解显碱性,促使油脂在碱性条件下水解从而溶解。(2分)(5)2O2--4e-=O2↑(2分),Al3+ +3e-=Al(2分) |
试题分析:(1)原子半径主要由电子层数、核电荷数决定,同周期元素电子层数相同,原子半径由核电荷数决定,核电荷数越小,半径越大,所以M短周期原子半径最大的元素是Na,位于元素周期表的第三周期第一主族;构成蛋白质的基础元素X、Y、Z、L分别是H、C、N、O,地壳中含量最多的金属元素是Al,所以N是Al元素,六种元素的原子半径从大到小的顺序为Na>Al>C>N>O>H (2)Z、X两元素按原子数目比l∶3构成分子A,A是NH3,其电子式为 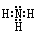 Y、L两元素按原子数目比l∶2构成分子B,B为CO2,CO2中所含的化学键类型为极性共价键; Y、L两元素按原子数目比l∶2构成分子B,B为CO2,CO2中所含的化学键类型为极性共价键;(3)O、Se是同主族元素,从上到下随原子半径逐渐增大,元素原子得电子的能力减弱,所以非金属性减弱 (4)用Y、L、M构成的正盐溶液为碳酸钠溶液,CO32-水解CO32- + H2O 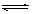 HCO3- +OH-,使溶液显碱性,促使油脂在碱性条件下水解从而溶解 HCO3- +OH-,使溶液显碱性,促使油脂在碱性条件下水解从而溶解(5)用石墨作电极,电解AlCl3溶液,和电解食盐水类似,得到Al(OH)3,Al(OH)3受热分解生成化合物QAl2O3,电解熔融Al2O3时,阳极是O2-放电,产生氧气,电极反应方程式是2O2--4e-=O2↑,阴极是Al3+放电,电极方程式为Al3+ +3e-=Al |
相似问题
A B C D为原子序数依次增大的四种短周期元素 其性质或结构信息如下表:试回答以下问题(1)B在周
A、B、C、D为原子序数依次增大的四种短周期元素,其性质或结构信息如下表:试回答以下问题(1)B在周期表中的位置是。B的氢化物与E的氢化物比较,沸点较
四种短周期元素W X Y Z的原子序数依次递增 X的一种单质能在空气中自燃。电解含有Y和Z的阴离子的
四种短周期元素W、X、Y、Z的原子序数依次递增,X的一种单质能在空气中自燃。电解含有Y和Z的阴离子的混合溶液时,在阳极Y离子先失去电子。W和Z同主族。对
短周期元素A B C D的原子序数依次递增 它们的核电荷数之和为32 各原子最外层电子数之和为10。
短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,各原子最外层电子数之和为10。A与C同主族,B与D同主族,A、C原子的最外层电子数之和
下列有关化学用语使用正确的是( ) A.硫原子的原子结构示意图:B.NH4Cl的电子式:C.原子
下列有关化学用语使用正确的是()A.硫原子的原子结构示意图:B.NH4Cl的电子式:C.原子核内有10个中子的氧原子:D.纯碱的化学式为NaOH
X Y Z W 属于同周期的短周期主族元素 原子序数依次增大 它们的原子最外层电子数之和为17 且Y
X、Y、Z、W 属于同周期的短周期主族元素,原子序数依次增大,它们的原子最外层电子数之和为17,且Y原子最外层电子数是X原子最外层电子数的3倍,W的内层












