(13分)(1)钠镁铝三种元素中第一电离能最大的是 。(2)某正二价阳离子核外电子排布式为
| (13分)(1)钠镁铝三种元素中第一电离能最大的是 。 (2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为 。 (3)微粒间存在非极性键、配位键、氢键及范德华力的是 。
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液。该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式 。 |
参考解答
| (1)镁;(2)Mn;(3)E;(4)N2(g)+3H2(g)=2NH3(g) △H=-93kJ/mol; (5)乙醇分子间能形成氢键,而二甲醚不能。(6) 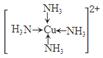 |
试题分析:(1)钠、镁、铝是同一周期的元素,随着原子序数的增大,原子半径逐渐减小,元素失去电子逐渐减弱,乙醇元素的第一电离能逐渐增大,但是Mg原子的2s轨道上的电子处于全充满的稳定状态,失去电子比后面相邻的Al还难。故这三种元素中第一电离能最大的是Mg;(2)失去2个电子后的某正二价阳离子核外电子排布式为[Ar]3d54s0,有23个电子,则原子有25个电子,所以是25号元素Mn。(3)A. NH4Cl晶体是离子晶体,含有离子键、极性共价键、配位键。错误。B. Na3AlF6晶体是离子晶体,含有离子键、共价键配位键。错误。C. Na2CO3?10H2O晶体是离子晶体,含有离子键、极性共价键、配位键。错误。D. CuSO4溶液中含有离子键、共价键、配位键。错误。E. CH3COOH溶液中含有CH3COOH分子内的极性共价键、非极性性共价键;分子之间的范德华力、氢键、H+与H2O之间的配位键。正确。(4)反应热就是断裂化学键吸收的能量与形成化学键释放的能量的差值。根据各种物质的键能可计算出氮气和氢气合成氨气的热化学方程式:N2(g)+3H2(g)=2NH3(g) △H=-93kJ/mol;(5)乙醇和二甲醚沸点及水溶性差异的主要原因是乙醇分子间能形成氢键,而二甲醚不能。(6)Cu被H2O2氧化为Cu2+,在浓氨水中形成[Cu(NH3)4 2+而使溶液深蓝色,呈深蓝色的离子的结构简式 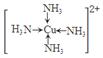 。 。 |
相似问题
四种短周期元素W R P Q的原子序数依次增大 W的一种核素没有中子 R Q同主族 R元素原子的最外
四种短周期元素W、R、P、Q的原子序数依次增大,W的一种核素没有中子,R、Q同主族,R元素原子的最外层电子数是内层电子数的3倍,P元素与R元素形成的常见化
在一定条件下 RO与R-可发生反应:RO+5R-+6H+===3R2+3H2O 下列关于R元素的叙述
在一定条件下,RO与R-可发生反应:RO+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )A.元素R位于周期表中第ⅤA族B.RO中的R只能被还
【化学—选修3:物质结构和性质】(15分)元素周期表是研究元素原子结构及性质的重要工具。现有X Y和
【化学—选修3:物质结构和性质】(15分)元素周期表是研究元素原子结构及性质的重要工具。现有X、Y和Z三种元素,其原子序数依次减小。X元素原子的4p轨道
(14分)X Y Z D E W是原子序数依次递增的短周期主族元素。(1)Y元素的气态氢化物与其最高
(14分)X、Y、Z、D、E、W是原子序数依次递增的短周期主族元素。(1)Y元素的气态氢化物与其最高价氧化物对应水化物能发生化合反应生成一种盐,该反应的化
右图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )A.Y R两种元素的气态
右图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是()A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸B.简单离子的












