【化学—选修3:物质结构和性质】(15分)元素周期表是研究元素原子结构及性质的重要工具。现有X Y和
| 【化学—选修3:物质结构和性质】(15分) 元素周期表是研究元素原子结构及性质的重要工具。现有X、Y和Z三种元素,其原子序数依次减小。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3。Z元素既可以形成正一价离子也可形成负一价离子。请回答下列问题: (1)Y元素原子的价层电子的轨道表示式为______________,该元素的名称是_____; (2)在X与Z形成的化合物XZ3中,X的杂化类型是 ,该化合物的空间构型为_____________;短周期元素形成的化合物中与XZ3互为等电子体的是 ; (3)请写出X的两种含氧酸的化学式 、 ,其中酸性较强的是 。 (4)Q与Z同主族。Q单质的晶胞如下图所示,若设该晶胞的密度为ag/cm3,阿伏加德罗常数为NA,Q原子的摩尔质量为M,则表示Q原子半径的计算式为 。  |
参考解答
| (15分) (1) 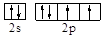 或 或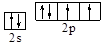 (2分) 氧。(1分) (2分) 氧。(1分) (2)sp3(2分),三角锥形。(1分)NH3、PH3(2分,每个1分) (3)H3AsO3、H3AsO4。(共2分,各1分)H3AsO4(1分) (4) 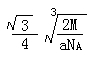 (4分,只要有这个式子即给4分,有无单位或对错均不考虑。) (4分,只要有这个式子即给4分,有无单位或对错均不考虑。) |
试题分析:X元素原子的4p轨道上有3个未成对电子,所以X是第四周期第五主族元素As元素;Y元素原子的最外层2p轨道上有2个未成对电子,则2p上的电子可能是2个也可能是4个,所以Y元素可能是C或O;X跟Y可形成化合物X2Y3,说明Y的化合价为-2价,所以Y是O元素;Z元素既可以形成正一价离子也可形成负一价离子,则Z是H元素。 (1)Y元素原子最外层6个电子,所以价电子的轨道表示式为 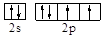 ;该元素是O; ;该元素是O;(2)在X与Z形成的化合物XZ3中,即AsH3,As的价层电子对数=3+1/2(5-3)=4,所以As是sp3杂化;空间构型为三角锥型;短周期元素形成的化合物中与XZ3互为等电子体的是同主族元素的氢化物NH3、PH3; (3)As的两种含氧酸的化学式为H3AsO3、H3AsO4。根据酸性强弱的判断依据,同种元素的化合价越高,其含氧酸的酸性越强,所以H3AsO4的酸性强; (4)由图可知,该晶胞中Q原子的个数是8×1/8+1=2,设晶胞的棱长为xcm,原子半径为rcm,则4r= 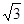 x,根据已知得a=2M/NAx3,可计算出x,所以r= x,根据已知得a=2M/NAx3,可计算出x,所以r=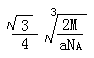 |
相似问题
(14分)X Y Z D E W是原子序数依次递增的短周期主族元素。(1)Y元素的气态氢化物与其最高
(14分)X、Y、Z、D、E、W是原子序数依次递增的短周期主族元素。(1)Y元素的气态氢化物与其最高价氧化物对应水化物能发生化合反应生成一种盐,该反应的化
右图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )A.Y R两种元素的气态
右图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是()A.Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸B.简单离子的
下列说法正确的是A.某粒子的电子数等于质子数 则该粒子可能是一种分子或一种离子B.构成单质的分子中一
下列说法正确的是A.某粒子的电子数等于质子数,则该粒子可能是一种分子或一种离子B.构成单质的分子中一定含有共价键C.溶液和胶体的本质区别是有无丁达
x y z三种短周期元素的原子半径依次变小 原子序数之和为16;这三种元素形成的常见单质分别为X Y
x、y、z三种短周期元素的原子半径依次变小,原子序数之和为16;这三种元素形成的常见单质分别为X、Y、Z,它们在适当条件下可发生如下图所示转化关系;其
【化学——选修3:物质结构与性质】(15分)已知A B C D E是元素周期表中1~36号元素 其原
【化学——选修3:物质结构与性质】(15分)已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素。A与另外四种元












