【化学——选修3:物质结构与性质】(15分)已知A B C D E是元素周期表中1~36号元素 其原
| 【化学——选修3:物质结构与性质】(15分) 已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素。A与另外四种元素既不在同一周期,也不在同一主族。B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图。 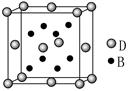 请回答下列问题: (1)C-的电子排布式为______________;E元素原子的价电子排布式为________。 (2)元素B与氮元素可以形成化合物NB3,其中N—B键的化学键类型为________,根据价层电子对互斥理论可以判断NB3的空间构型为________,NB3分子中N原子的杂化方式为________杂化。 (3)A、B形成的化合物AB的相对分子质量比A、C形成的化合物AC的相对分子质量小,但AB的沸点比AC高,其原因是 。 (4)从晶胞图可以得出:D与B形成的离子化合物的化学式为 。 (5)含有D元素的化合物焰色反应为______色,焰色反应的原理是 。 |
参考解答
| (15分)(1)1s22s22p63s23p6(2分) 3d54s2(2分) (2)共价键(或极性共价键)(1分) 三角锥形(1分) sp3(2分) (3)前者分子间存在氢键(2分) (4)CaF2(2分) (5)砖红(1分) 激发态电子从能量较高的轨道跃迁到能量较低的轨道,以光的形式释放出能量(2分) |
试题分析:元素E是周期表中的第7列元素,所以E是Mn元素;D的最外层电子数与最内层电子数相同,且与E同周期,所以D是第四周期第二主族元素Ca元素;D跟B可形成离子化合物,根据晶胞结构判断,该晶胞中有4个D、8个B,所以该离子化合物的化学式为DB2,则B为第七主族元素,B和C同主族,因此B、C分别是F、Cl元素;A与另外四种元素既不在同一周期,也不在同一主族,所以A是H元素。根据以上分析: (1)Cl-的核外有18个电子,电子排布式为1s22s22p63s23p6;Mn是第七副族元素,价电子排布式为 3d54s2; (2)氨气分子中含有共价键;NF3分子中中心原子的价层电子对数=3+1/2(5-3×1)=4,有1对孤对电子,所以空间构型为三角锥形;利用杂化轨道理论判断N原子的杂化方式为 sp3杂化。 (3)HF的沸点比HCl的沸点高的原因是HF分子间可以形成氢键,使分子间作用力增大; (4)根据上面分析知D与B形成的离子化合物的化学式为CaF2; (5)根据焰色反应判断Ca的焰色反应为砖红色;原理是激发态电子从能量较高的轨道跃迁到能量较低的轨道,以光的形式释放出能量。 |
相似问题
若aAn+与bB2-两种离子的核外电子层结构相同 则a的数值为( )A.b+n+2B.b+n-
若aAn+与bB2-两种离子的核外电子层结构相同,则a的数值为( )A.b+n+2B.b+n-2C.b-n-2D.b-n+2
【选修3-物质的结构与性质】(15分)上表为周期表的一部分 其中的编号代表所对应的元素。请回答下列问
【选修3-物质的结构与性质】(15分)上表为周期表的一部分,其中的编号代表所对应的元素。请回答下列问题:(1)⑨号元素的基态原子的价电子排布式是____
A B C D为原子序数依次增大的前四周期元素 元素A原子最外层电子数比内层多3个 元素B基态原子核
A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于
(12分)下表为元素周期表的一部分 请参照元素①-⑨在表中的位置 用化学用语回答下列问题: 族周期I
(12分)下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题: 族周期IA01①ⅡAⅢAⅣAⅤAⅥAⅦA2②③④3⑤⑥⑦⑧⑨(1)在
甲 乙是周期表中同一主族的两种元素 若甲的原子序数为X 则乙的原子序数不可能为 ( )A.X
甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X,则乙的原子序数不可能为 ( )A.X+32B.X+4C.X+8D.X+18












