在实验室中 可利用碳酸氢钠 氯化钠 氯化铵等物质溶解度的差异 通过饱和食盐水 氨和二氧化碳反应 获得
在实验室中,可利用碳酸氢钠、氯化钠、氯化铵等物质溶解度的差异,通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O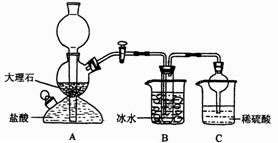 (1)A装置中所发生反应的离子方程式为 。 C装置中稀硫酸的作用为 。 (2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水) 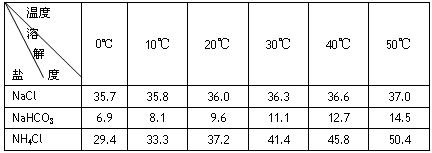 参照表中数据,请分析B装置中使用冰水是因为 。 (3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用是 。 (4)利用改进后的装置进行实验,在B中的试管内析出了晶体,经必要的操作后得到了一种纯净的晶体。现有下列试剂:盐酸、浓氨水、生石灰、蒸馏水,利用本题所提供的试剂(只限一种)及试管、酒精灯等主要仪器,通过简单实验判断该晶体是碳酸氢钠晶体,而不是碳酸氢铵或食盐晶体,简述操作方法、实验现象及结论: 。 (5)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为 。 |
参考解答
| (1)(2分)CaCO3+2H+ 的氨气,减少对环境的污染 (2)(2分)温度越低,碳酸氢钠的溶解度越小,便于析出(3) (1分)A与B(1分)饱和NaHCO3溶液(其他合理答案均可给分)(2分)除去CO2中混 合的HCl气体(4)(5分)取少量晶体置于试管中,在酒精灯上加热使其充分反应后,还 有白色固体剩余,则晶体不是NH4HCO3;待试管冷却后,向剩余固体中加入适量盐酸,若 反应并产生大量气泡,则晶体是NaHCO3,而不是食盐。(其他合理答案均可给分)(5)(2 分)60% |
| 略 |
相似问题
下列物质在空气中久置 因发生氧化还原反应而变质的单质是( )A.NaB.NaOHC.Na2CO
下列物质在空气中久置,因发生氧化还原反应而变质的单质是( )A.NaB.NaOHC.Na2CO3·10H2OD.Na2O2
呼吸面具里有Na2O2 可吸收CO2放出O2 若用超氧化钾(KO2)代替过氧化钠 也能吸收CO2生成
呼吸面具里有Na2O2,可吸收CO2放出O2,若用超氧化钾(KO2)代替过氧化钠,也能吸收CO2生成碳酸盐和O2。(1)写出KO2与CO2反应的化学方程式。(2)1 kg Na2O2和1
1块表面已经氧化为氧化钠(Na2O)的金属钠的质量为10.8 g 把它投入100 g水中 在常温下放
1块表面已经氧化为氧化钠(Na2O)的金属钠的质量为10 8 g,把它投入100 g水中,在常温下放出氢气0 2 g,求:(1)金属钠的纯度为多少?(2)被氧化的金
相同质量的Na Mg Al分别与足量盐酸充分反应 生成氢气的质量比为( )A.1∶2∶3B.2
相同质量的Na、Mg、Al分别与足量盐酸充分反应,生成氢气的质量比为( )A.1∶2∶3B.23∶24∶37C.23∶12∶9D.36∶69∶92
将少量金属钠投入到氯化铁溶液中 产物是:A.NaOH H2 B.Fe NaClC.Fe(OH)3 N
将少量金属钠投入到氯化铁溶液中,产物是:A.NaOH、H2 B.Fe、NaClC.Fe(OH)3、NaCl、H2D.H2、NaCl、NaOH












