1块表面已经氧化为氧化钠(Na2O)的金属钠的质量为10.8 g 把它投入100 g水中 在常温下放
| 1块表面已经氧化为氧化钠(Na2O)的金属钠的质量为10.8 g,把它投入100 g水中,在常温下放出氢气0.2 g,求: (1)金属钠的纯度为多少? (2)被氧化的金属钠的质量为多少? (3)生成氢氧化钠的质量。 (4)所得溶液中溶质的质量分数。 |
参考解答
| 设10.8 g反应物中含金属钠的质量为x,根据: 2Na+2H2O  2NaOH+H2↑ 2NaOH+H2↑23×2 40×2 2 x y 0.2 g x= 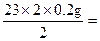 4.6 g 4.6 gy= 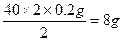 (1)金属钠的纯度: 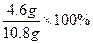 =42.59% =42.59%(2)反应物中含氧化钠:m(Na2O)='10.8' g-4.6 g='6.2' g 氧化钠中钠元素(即被氧化的钠)的质量为z。 62∶46='6.2' g∶z z='4.6' g (3)设氧化钠溶于水生成的氢氧化钠的质量为b。 Na2O+H2O  2NaOH 2NaOH62 2×40 6.2 g b 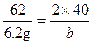 b='8' g b='8' gm(NaOH)='8' g+8 g='16' g (4)计算溶质的质量分数,必须求出反应后溶液的总质量,根据质量守恒关系, m(溶液)=m(H2O)+m(Na)+m(Na2O)-m(H2)='100' g+10.8 g-0.2 g='110.6' g 溶质的质量分数为:  ×100%=14.47% ×100%=14.47%答:(1)金属钠的纯度为42.59%。 (2)被氧化的金属钠的质量为4.6 g。 (3)生成的氢氧化钠的质量为16 g。 (4)溶质的质量分数为14.47%。 |
| 10.8 g固体反应物实际上是金属钠和氧化钠的混合物,其中只有金属钠能与水反应产生氢气。而氢氧化钠是钠、氧化钠与水反应的共同产物。根据反应的化学方程式,从放出氢气的质量可求出金属钠的质量及氧化钠的质量。 解题时要注意的是:金属钠溶于水所得溶液的溶质是氢氧化钠而不是金属钠。在计算溶液中溶质的质量分数而求算溶液质量时,不能忽略反应中产生的氢气的质量,即从溶液质量中将其减去才能求出正确的溶液质量。 还须注意的是:被氧化的金属钠的质量不能理解为被氧化生成的氧化钠的质量,应先求出氧化钠的质量,再求出其中所含钠元素的质量,这才是被氧化的金属钠的质量。 |
相似问题
相同质量的Na Mg Al分别与足量盐酸充分反应 生成氢气的质量比为( )A.1∶2∶3B.2
相同质量的Na、Mg、Al分别与足量盐酸充分反应,生成氢气的质量比为( )A.1∶2∶3B.23∶24∶37C.23∶12∶9D.36∶69∶92
将少量金属钠投入到氯化铁溶液中 产物是:A.NaOH H2 B.Fe NaClC.Fe(OH)3 N
将少量金属钠投入到氯化铁溶液中,产物是:A.NaOH、H2 B.Fe、NaClC.Fe(OH)3、NaCl、H2D.H2、NaCl、NaOH
(10分)工业碳酸钠(纯度约为98%)中常含有Ca2+ Mg2+ Fe3+ Clˉ和SO42ˉ等杂质
(10分)工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的工艺流程图如下:已知:
在长期载人太空飞行的宇航器中 每个宇航员平均每天需要消耗0.9 kg氧气 呼出1.0 kg二氧化碳
在长期载人太空飞行的宇航器中,每个宇航员平均每天需要消耗0 9 kg氧气,呼出1 0 kg二氧化碳,为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了
关于Na2CO3和NaHCO3性质的说法不正确的是 A.热稳定性:NaHCO3<Na2CO3B.与同
关于Na2CO3和NaHCO3性质的说法不正确的是 A.热稳定性:NaHCO3<Na2CO3B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3C.相同温度时,在水中的溶解性:












