(10分)工业碳酸钠(纯度约为98%)中常含有Ca2+ Mg2+ Fe3+ Clˉ和SO42ˉ等杂质
(10分)工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的工艺流程图如下: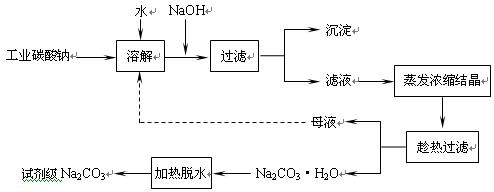 已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示: 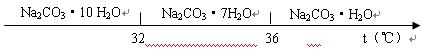  (1)加入NaOH溶液时发生的离子反应方程式为 ▲ 、 ▲ 。 (1)加入NaOH溶液时发生的离子反应方程式为 ▲ 、 ▲ 。(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释) ▲ 。 (3)“趁热过滤”时的温度应控制在 ▲ 。 (4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+532.36kJ·mol—1 Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+473.63kJ·mol—1 写出Na2CO3·H2O脱水反应的热化学方程式 ▲ 。 (5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用。请你分析实际生产中是否可行 ▲ ,其理由是 ▲ 。 |
参考解答
| (1)Fe3++3OHˉ=Fe(OH)3↓、MgCO3 +2OHˉ=Mg (OH)2↓+CO32— (2)因Na2CO3在溶液中存在水解平衡CO32-+H2O  HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强 HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强(3)高于36℃ (4)Na2CO3·H2O(s)=Na2CO3(s) +H2O(g) △H=+58.73kJ·mol—1 (5)不可行 若“母液”循环使用,则溶液中c(Cl—)和c(SO42—)增大,最后所得产物Na2CO3混有杂质 (每小题2分,共10分) |
| 略 |
相似问题
在长期载人太空飞行的宇航器中 每个宇航员平均每天需要消耗0.9 kg氧气 呼出1.0 kg二氧化碳
在长期载人太空飞行的宇航器中,每个宇航员平均每天需要消耗0 9 kg氧气,呼出1 0 kg二氧化碳,为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了
关于Na2CO3和NaHCO3性质的说法不正确的是 A.热稳定性:NaHCO3<Na2CO3B.与同
关于Na2CO3和NaHCO3性质的说法不正确的是 A.热稳定性:NaHCO3<Na2CO3B.与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3C.相同温度时,在水中的溶解性:
在一定温度下 向饱和烧碱溶液中投入一小块金属钠 充分反应后恢复到原来的温度 下列说法正确的是(
在一定温度下,向饱和烧碱溶液中投入一小块金属钠,充分反应后恢复到原来的温度,下列说法正确的是()A.溶液中Na+浓度增大,有H2放出B.溶液中Na+数目
取各组内两种金属的混合物6 g投入水中 收集到0.2 g H2 不可能构成此种混合物的是( )
取各组内两种金属的混合物6 g投入水中,收集到0 2 g H2,不可能构成此种混合物的是( )A.Li和NaB.Rb和CaC.Na和CuD.Na和K
将总物质的量为m mol的Na2O2和NaHCO3的混合物在密闭容器中加热至2.50℃ 使其充分反应
将总物质的量为m mol的Na2O2和NaHCO3的混合物在密闭容器中加热至2 50℃,使其充分反应,NaHCO3在混合物中的物质的量分数为x。(1)当x=l 2时,容器中固












