(6分)硅酸钠(Na2SiO3)是我国优先发展的精细化工产品 工业制备的反应为:2NaOH+ SiO
| (6分)硅酸钠(Na2SiO3)是我国优先发展的精细化工产品,工业制备的反应为: 2NaOH+ SiO2 ="=" Na2SiO3 + H2O 。现以125t石英砂(SiO2质量分数为96%)为原料,与 足量的NaOH溶液反应。试计算: (1)125t石英砂中SiO2的质量。 (2)理论上得到硅酸钠的质量。 |
参考解答
| (6分)解:(1)石英砂中的SiO2的质量=125t×96%=120t(2分) (2)设生成硅酸钠的质量为x 2NaOH + SiO2 == Na2SiO3 + H2O 60 122 120t x 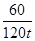 = =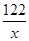 X='244t' ……………………………………………………4分 答:略。 |
| (1)根据石英砂中SiO2质量分数为96%,由石英砂的质量计算其中SiO2的质量;(2)根据反应的化学方程式,利用石英砂中SiO2的质量计算反应可生成硅酸钠的质量。 【解答】解:(1)石英砂中的SiO2的质量=125t×96%=120t (2)设生成硅酸钠的质量为x 2NaOH+SiO2═Na2SiO3+H2O 60 122 120t x 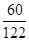 = =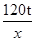 x=244t x=244t答:(1)125t石英砂中SiO2的质量为120t; (2)理论上得到硅酸钠的质量为244t。 【点评】根据化学方程式进行计算时,所使用的物质的质量应为纯净物的质量,不可把混合物的质量直接代入进行计算。 |
相似问题
在化合反应2A+B2==2AB中 A与B2反应的质量关系如右图所示 现将6gA和8g B2充分反应
在化合反应2A+B2==2AB中,A与B2反应的质量关系如右图所示,现将6gA和8g B2充分反应,则生成AB的质量是A.9gB.11gC.12gD.14g
(5分)有氯酸钾和二氧化锰的混合物共27.5 g 加热使之反应 待反应至不再有气体生成后 将试管冷却
(5分)有氯酸钾和二氧化锰的混合物共27.5 g,加热使之反应,待反应至不再有气体生成后,将试管冷却、称量,得到剩余固体17.9 g。求:⑴制取氧气的质
向KI溶液中加入AgNO3溶液直到刚好沉淀完全为止 反应后溶液的质量恰好等于原碘化钾溶液中溶质的质量
向KI溶液中加入AgNO3溶液直到刚好沉淀完全为止,反应后溶液的质量恰好等于原碘化钾溶液中溶质的质量,则该AgNO3溶液中溶质的质量分数为多少?注:KI+AgNO
要炼得56t含杂质3%的生铁 需要含Fe2O380%的赤铁矿多少吨?
要炼得56t含杂质3%的生铁,需要含Fe2O380%的赤铁矿多少吨?
为了验证质量守恒定律。甲 乙 丙三位同学各做了一个实验。(1)甲同学用实验测定的数据有:木炭和坩埚的
为了验证质量守恒定律。甲、乙、丙三位同学各做了一个实验。(1)甲同学用实验测定的数据有:木炭和坩埚的总质量mg;其燃烧后灰烬和坩埚的总质量为ng。 m












