(5分)有氯酸钾和二氧化锰的混合物共27.5 g 加热使之反应 待反应至不再有气体生成后 将试管冷却
| (5分) 有氯酸钾和二氧化锰的混合物共27.5 g,加热使之反应,待反应至不再有气体生成后,将试管冷却、称量,得到剩余固体17.9 g。求: ⑴制取氧气的质量是多少g?(2分) ⑵剩余固体中含有哪些物质?各为多少克?(3分) |
参考解答
(1)9.6克 (2)剩余固体中有MnO2和KCl,,质量分别为:3g、14.9g |
| 分析:根据氯酸钾分解生成氧气的化学方程式可知,只有氧气是气体,则可利用反应前后固体的质量差来计算氧气的质量,然后将氧气的质量代入化学方程式来计算生成的氯化钾的质量来解答. 解答:解:(1)因反应中氧气为气体,则氧气质量为26.5g-16.9g═9.6g, 答:制取氧气的质量为9.6g; (2)因反应至不再有气体生成,则氯酸钾完全分解, 剩余固体中含氯化钾和二氧化锰,设氯化钾的质量为x,则 2KClO3 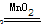 2 KCl+3O2↑ 2 KCl+3O2↑149 96 x 9.6g 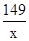 = =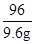 解得x=14.9 g, 即氯化钾的质量为14.9g, 则二氧化锰质量为17.9 g-14.9g═3g, 答:剩余固体中氯化钾质量为14.9 g,二氧化锰质量质量为3g. |
相似问题
向KI溶液中加入AgNO3溶液直到刚好沉淀完全为止 反应后溶液的质量恰好等于原碘化钾溶液中溶质的质量
向KI溶液中加入AgNO3溶液直到刚好沉淀完全为止,反应后溶液的质量恰好等于原碘化钾溶液中溶质的质量,则该AgNO3溶液中溶质的质量分数为多少?注:KI+AgNO
要炼得56t含杂质3%的生铁 需要含Fe2O380%的赤铁矿多少吨?
要炼得56t含杂质3%的生铁,需要含Fe2O380%的赤铁矿多少吨?
为了验证质量守恒定律。甲 乙 丙三位同学各做了一个实验。(1)甲同学用实验测定的数据有:木炭和坩埚的
为了验证质量守恒定律。甲、乙、丙三位同学各做了一个实验。(1)甲同学用实验测定的数据有:木炭和坩埚的总质量mg;其燃烧后灰烬和坩埚的总质量为ng。 m
(2011年四川广安 32题)在一密闭容器中 有甲 乙 丙 丁四种物质 在一定条件下存在某个反应 测
(2011年四川广安,32题)在一密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下存在某个反应,测得反应前后各物质的质量如下表:物质甲乙丙丁反应前
小明同学通过学习化学 已经知道鸡蛋壳的成分中含有碳酸钙(CaCO3).现小明想进一步了解鸡蛋壳中碳酸
小明同学通过学习化学,已经知道鸡蛋壳的成分中含有碳酸钙(CaCO3).现小明想进一步了解鸡蛋壳中碳酸钙的质量分数,征得老师同意,进行以下实验:他把15












