氯酸钾受热分解的化学方程式为2KClO3MnO2.△2KCl+3O2↑ 对“24.5g氯酸钾受热完全
氯酸钾受热分解的化学方程式为2KClO3
(1)你认为他们的解题思路和方法都正确吗? (2)若要计算31.6g高锰酸钾受热完全分解产生氧气质量,你认为也能用上述两种方法解答吗?把能用的解法和过程写出来. 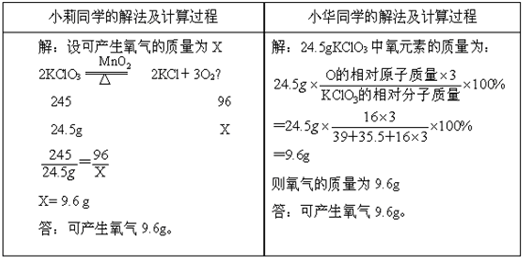 |
参考解答
| 答:(1)由分析可知两位同学的做法都正确; (2)不能.因为高锰酸钾中的氧元素没有全部变成氧气; 能用的计算方法和过程如下: 设高锰酸钾反应生成氧气的质量为x. 2KMnO4
316 32 31.6g x
x=3.2g 故答案为:(1)都正确;(2)不能(或能用小莉的解法)答:生成氧气的质量为3.2g. |
相似问题
由Ag和另一种金属组成的混合物共8克 将其加入足量的稀硫酸完全反应后 共收集到0.4克H2 则另一种
由Ag和另一种金属组成的混合物共8克,将其加入足量的稀硫酸完全反应后,共收集到0 4克H2,则另一种金属可能是( )A.CuB.ZnC.FeD.Mg
若9.6g不纯的(NH4)2CO3粉末样品[含的杂质可能是(1)NH4HCO3 (2)Na2CO3
若9 6g不纯的(NH4)2CO3粉末样品[含的杂质可能是(1)NH4HCO3,(2)Na2CO3,(3)SiO2跟足量稀H2SO4反应,共收集到4 5gCO2,且溶液中有残留不溶物.则
有一瓶标签破损的稀硫酸 为测定其溶质质量分数 取出20g溶液 加入足量的锌粒.充分反应后 产生的氢气
有一瓶标签破损的稀硫酸,为测定其溶质质量分数,取出20g溶液,加入足量的锌粒.充分反应后,产生的氢气为0 02g.①计算20g溶液中H2SO4的物质的量(根据
为了测定实验室中高锰酸钾样品的纯度(杂质不参加反应) 取16g该样品加热 完全反应后 得到1.6g氧
为了测定实验室中高锰酸钾样品的纯度(杂质不参加反应),取16g该样品加热,完全反应后,得到1 6g氧气,求样品中高锰酸钾的质量分数.
芯片是电脑的核心部件 它是用高纯度硅制成的.下面是生产单质硅过程中的一个重要反应:SiO2+2C 高
芯片是电脑的核心部件,它是用高纯度硅制成的.下面是生产单质硅过程中的一个重要反应:SiO2+2C高温 Si+2CO↑.请计算:每生产112kg的硅,需要消耗多少千












