如下图所示 当关闭K时 向A 中充入2molX 7molY 向B中充入4molX 14molY 起始
如下图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时V(A)=V(B)=a升,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g) Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答: Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a升,试回答: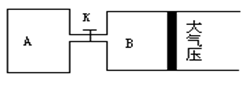 (1)B中X 的转化率α(X)B为 。 (2)A中W和B中Z的物质的量的比较:n(W)A n(Z)B(填<、>、或=) (3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为 升(用a表示,连通管中气体体积不计) (4)要使B容器恢复原来反应前的体积,可采取的措施是 。 |
参考解答
| (1)90% (2)< (3)0.35a (4)升高温度 |
| (1)平衡时B中总物质的量为:0.9a×18/a=16.2mol,设:参加反应的X为nXmol有:2∶1=nX∶(18-16.2)nX=3.6molα(X)B=3.6/4=90℅ (2)B平衡状态可视为A状态体系体积缩小一半形成的,而A体系体积缩小时,平衡向正方向移动,也就是B中Z的物质的量在2倍于A中Z的物质的量的基础上有所增加,又A中W物质的量是Z的2倍,所以B中Z的物质的量大于A中W的物质的量。 (3)打开K意味着A、B在等温等压下建立平衡,与B中平衡状态等效,A、B可视为一个容器,其中A的转化率仍为90℅,求得平衡时总物质的量为:6-6×0.9+体积。 |
相似问题
如图表示反应X(g)4Y(g)+Z(g) △H
如图表示反应X(g)4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是A.第6后,反应就终止了B.的平衡转化率为85%C.
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)zC(g) 平衡时测得A的浓度为0.50
在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)zC(g),平衡时测得A的浓度为0 50mol L,保持温度不变,将容器的容积扩大到原来的两倍,测得A
已知 I2(aq)+I-(aq)I3-(aq)。某I2 KI混合溶液中 c(I3-)与温度(T)的
已知,I2(aq)+I-(aq)I3-(aq)。某I2、、KI混合溶液中,c(I3-)与温度(T)的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法中,正确的是A
一定温度下 有可逆反应:2A(g)+2B(g)C(g)+3D(g);ΔH<0。现将2molA和2mo
一定温度下,有可逆反应:2A(g)+2B(g)C(g)+3D(g);ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的
在同温同压有催化剂存在下 向一固定容积的容器中充入N2 H2 发生N2+3H22NH3反应 在下列比
在同温同压有催化剂存在下,向一固定容积的容器中充入N2、H2,发生N2+3H22NH3反应,在下列比例中,生成NH3的量最多的是:A.3:1B.1:2C.2:1D.3:8












