一定温度下 有可逆反应:2A(g)+2B(g)C(g)+3D(g);ΔH<0。现将2molA和2mo
一定温度下,有可逆反应:2A(g)+2B(g) C(g)+3D(g);ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。 C(g)+3D(g);ΔH<0。现将2molA和2molB充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。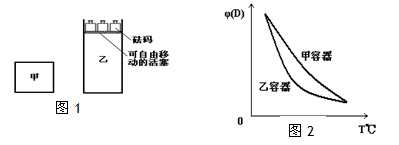 关于两容器中反应的说法正确的是 A.甲容器中的反应先达到化学平衡状态 B.两容器中反应均达平衡后,平衡体系中各组分的体积百分组成相同,浓度也相同 C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示 D.在甲容器中再充入2 mol A和2 mol B,平衡后甲中c(C)是乙中c(C)的2倍 |
参考解答
| BD |
| A 错误,乙中的反应等价于起始状态下的4摩尔A和4摩尔B的反应,甲恒容,乙恒压,由于该反应是气体体积数不变的反应,所以甲乙两容器自始至终各成分的浓度均相等,正逆反应速度任何时刻均相等,故甲乙两容器应同时达到化学平衡状态 B 正确 上述分析知甲乙两容器达到的平衡状态完全相同,故平衡体系中各组分的体积百分组成相同,浓度也相同 C 错误 两容器达平衡后升高相同的温度时,平衡左移两容器中物质D的体积分数随温度变化的情况也相同 D 正确 设想另有一与甲完全相同的容器,在相同条件下完成上述反应,此时平衡状态与甲应完全相同,再假想把该容器中的反应混合物挤入甲容器中,于是相当于给甲加压并使其容积减小一半,平衡不移动,但平衡混合物中各成分的浓度都增大到原来的2倍,即平衡后甲中c(C)是乙中c(C)的2倍 |
相似问题
在同温同压有催化剂存在下 向一固定容积的容器中充入N2 H2 发生N2+3H22NH3反应 在下列比
在同温同压有催化剂存在下,向一固定容积的容器中充入N2、H2,发生N2+3H22NH3反应,在下列比例中,生成NH3的量最多的是:A.3:1B.1:2C.2:1D.3:8
在一定温度下将各1mol CO和水蒸气放在密闭的容器中反应:CO(g)+H2O(g) CO2(g)+
在一定温度下将各1mol CO和水蒸气放在密闭的容器中反应:CO(g)+H2O(g) CO2(g)+ H2(g)达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到
如图表示反应M(g)+P(g)nQ(g)的平衡体系中 Q的物质的量浓度c(Q)与温度T的关系(曲线上
如图表示反应M(g)+P(g)nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线上的任何一点都表示平衡状态)。下列有关该反应的描述错误的是 ( )
在4L密闭容器中充入6molA气体和5molB气体 在一定条件下发生反应:3A(g)+B(g)2C(
在4L密闭容器中充入6molA气体和5molB气体,在一定条件下发生反应:3A(g)+B(g)2C(g)+xD(g),5s达到平衡。达到平衡时,生成了2molC,经测定D的浓度为0 5mol
有一处于平衡状态的反应A(g) + 3B(g)2C(g)△H
有一处于平衡状态的反应A(g) + 3B(g)2C(g)△H<0,为了使平衡向生成C的方向移动,应选择的条件是〔〕①升高温度②降低温度③ 增大压强④降低压强⑤加入












