空气吹出法工艺是目前“海水提溴”的最主要方法之一 其工艺流程如下:(1)目前 从海水中提取的溴约占世
空气吹出法工艺是目前“海水提溴”的最主要方法之一,其工艺流程如下: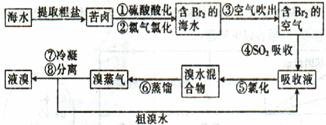 (1)目前,从海水中提取的溴约占世界溴年产量的 。 (2)步骤①中用硫酸酸化可提高Cl2的利用率,其原因是 。 (3)步骤④的离子方程式。 (4)步骤⑥的蒸馏过程中,溴出口温度要控制在80?90℃。温度过高或过低都不利于生产,理由是 。 (5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差较大的特点进行分离。分离仪器的名称是 ,分离吋液溴从分离器的 (填“上口”或“下口”)排出。 (6)不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”的原因是 。 (7)某同学测得苦卤中溴的含量为0.8g·L-1,已知步骤①?⑥中溴共损失了25%,步骤⑦和步骤⑧又共损失了所得溴蒸气的10%,若处理10 m3这样的苦卤,可得到液溴 mol。 |
参考解答
(1) 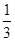 (2)酸化可抑制Cl2、Br2与水反应 (3)Br2+SO2+2H2O==4H++2Br-+SO42- (4)温度过高,大量水蒸气随水排出去,溴蒸气中水分增加,温度过低,溴不能完全蒸出,吸收率低。 (5)分液漏斗;下口 (6)氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高,“空气吹出、SO2吸收、氯化”的过程实际是一个溴的浓缩过程。 (7)33.75 |
试题分析:(1)从海水中提取的溴约占世界溴年产量的 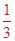 。 。(2)Cl2、Br2与水反应生成酸,加入硫酸可抑制Cl2、Br2与水反应。 (3)步骤④是溴单质将SO2氧化。 (4)温度过高,会增加水蒸气,温度过低,则溴不能完全蒸出。 (5)分离溴水和液溴,应用分液漏斗。因液溴密度大于水,因此液溴从分液漏斗下口排出。 (6)氯化后的海水含溴量低。 (7) 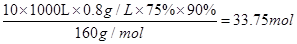 。 。 |
相似问题
下列各组溶液 只用一种试剂无法区别的是A.硫酸钠 硫化钠 亚硫酸钾 硫代硫酸钾 偏铝酸钠B.氯化铁
下列各组溶液,只用一种试剂无法区别的是A.硫酸钠、硫化钠、亚硫酸钾、硫代硫酸钾、偏铝酸钠B.氯化铁、氯化铵、硫酸钠、硫酸镁、硫酸铝C.硫氰化钾、氯
分别取四种溶液于四支试管中进行实验 结论正确的是 操作现象结论A加入浓NaOH溶液 加热湿润的红色石
分别取四种溶液于四支试管中进行实验,结论正确的是操作现象结论A加入浓NaOH溶液,加热湿润的红色石蕊试纸变蓝原溶液中一定含有NH4+B加入稀盐酸,将产生
为除去某物质中所含的杂质 所选用的试剂或操作方法正确的是序号物质杂质除杂质应选用的试剂或操作方法①K
为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是序号物质杂质除杂质应选用的试剂或操作方法①KNO3溶液KOH滴入稀HNO3同时用pH试纸测定至溶液呈
(10 分)氧化镁在医药 建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(
(10 分)氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧
实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )A.装置③可用于收集H2 CO2
实验是化学研究的基础。下列关于各实验装置的叙述正确的是( )A.装置③可用于收集H2、CO2、Cl2、NH3等气体B.装置②可用于吸收NH3或HCl气体,并防止倒吸












