从回收的含铜电缆废料中提取铜时 假若设计如下两种方案 回答有关问题。方案甲:方案乙:(1)两个方案中
| 从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。 方案甲:  方案乙:  (1)两个方案中,符合当前生产中绿色化学理念的是方案 ,理由是 方案第一步“灼烧”会产生污染空气的气体、粉尘、烟雾。 (2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为________________ _ ______。 (3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测: ①先取a g的晶体进行脱水实验,获得无水固体为(a—1.26)g ②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。通过计算测知该晶体的化学式是 。 (4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5% 。工业上用硫酸铜等原料常通过下列反应制备CuCl : 2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3=2 CuCl ↓+ 3 Na2SO4 + CO2↑ 测定CuCl质量分数时先准确称取所制备的0.2500g CuCl样品置于一定量的0.5mol·L-1 FeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到终点,消耗24.60mL Ce(SO4)2溶液。有关反应的离子方程式为:Fe 3++CuCl=Fe 2++Cu2++Cl- ,Ce4+ + Fe 2+=Fe 3+ + Ce3+ 计算上述样品中CuCl的质量分数为 。 |
参考解答
(10分)(1)乙 ;甲 (2)2Cu + O2 +4H+ 2Cu2+ + 2H2O (3)FeSO4·7H2O (4)97.9% 2Cu2+ + 2H2O (3)FeSO4·7H2O (4)97.9% |
试题分析:(1)方案甲中电缆废料在空气中燃烧时能产生污有毒的气体、粉尘、烟雾而污染空气;而方案乙中不燃烧,所以不能产生有毒气体,因此方案乙符合绿色化学理念。 (2)在加热的条件下铜和氧气反应生成氧化铜,氧化铜溶解在稀硫酸中生成硫酸铜,反应的离子方程式为2Cu + O2 +4H+  2Cu2+ + 2H2O。 2Cu2+ + 2H2O。(3)取a g的晶体进行脱水实验,获得无水固体为(a—1.26)g,这说明反应中生成的水的质量是1.26g,物质的量是1.26g÷18g/mol=0.07mol;消耗氯化钡的物质的量是0.01mol,白色沉淀是硫酸钡,则根据原子守恒可知,晶体中SO42-的物质的量是0.01mol,所以晶体中硫酸亚铁和结晶水的个数之比是1:7,因此晶体的化学式为FeSO4·7H2O。 (4)根据离子方程式Fe 3++CuCl=Fe 2++Cu2++Cl- ,Ce4+ + Fe 2+=Fe 3+ + Ce3+可知, CuCl~Fe 2+~Ce4+ 1mol 1mol n 0.0246L×0.1000mol/L 解得n=0.00246mol 所以CuCl的质量=0.00246mol×99.5g/mol=0.24477g 因此上述样品中CuCl的质量分数为 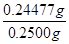 ×100%=97.9%。 ×100%=97.9%。 |
相似问题
下列物质提纯的方法正确的是A.除去乙醇中混有的乙酸:加入氢氧化钠溶液分液B.除去混在CO2中的SO2
下列物质提纯的方法正确的是A.除去乙醇中混有的乙酸:加入氢氧化钠溶液分液B.除去混在CO2中的SO2:将气体通过饱和碳酸钠溶液洗气C.除去KCl溶液中的K2C
海带中含有碘离子 某化学兴趣小组设计如下的步骤从海带中提取单质碘:( )①通足量氯气②将海带烧成
海带中含有碘离子,某化学兴趣小组设计如下的步骤从海带中提取单质碘:()①通足量氯气②将海带烧成灰,向灰中加水搅拌③加CCl4振荡④过滤⑤用分液漏斗
利用实验器材(规格和数量不限) 能完成相应实验的一项是 实验器材(省略夹持装置)相应实验A烧杯 玻璃
利用实验器材(规格和数量不限),能完成相应实验的一项是实验器材(省略夹持装置)相应实验A烧杯、玻璃棒、蒸发皿硫酸铜溶液的浓缩结晶B烧杯、玻璃棒、
某研究性学习小组拟取盐湖苦卤的浓缩液(富含Ca2+ Mg2+ Br- SO42- Cl-等) 来制取
某研究性学习小组拟取盐湖苦卤的浓缩液(富含Ca2+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的无水CaCl2及液溴,他们设计了如下流程:回答以下问题:
工业上用闪锌矿(主要成分为ZnS 还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如
工业上用闪锌矿(主要成分为ZnS,还含有Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学












