有位于周期表前四周期的A B C D E F六种元素 其原子序数依次增大。已知A原子核外有三个未成对
| 有位于周期表前四周期的A、B、C、D、E、F六种元素,其原子序数依次增大。已知A原子核外有三个未成对电子;A与B形成的一种化合物常温下是红棕色气体;化合物C2E的晶体为离子晶体;D单质的熔点在同周期单质中最高;E原子核外的M层中只有两对成对电子;F原子核外最外层电子数与C相同,其余各层均充满。请根据以上信息,回答下列问题: (1)A、B、C、D四种原子的第一电离能由小到大的顺序为______(用元素符号表示)。 (2)C的氯化物的熔点比D的氯化物的熔点 (填“高”或“低”),理由是 。 (3)E的最高价氧化物分子的空间构型是 。 (4)基态F+离子的核外电子排布式是 ,F的高价离子与A的最常见氢化物形成的配离子的化学式为 。 (5)Q分子是A2B的等电子体,Q的结构式为 ,Q分子的中心原子的杂化类型是 。 (6)下图是B、F两元素组成的一种化合物的晶胞,其化学式为 。 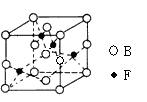 |
参考解答
| (1)Na、Si、O、N(或Na<Si<O<N,2分。填Na、Si、N、O或由大到小给1分) (2)高,(1分) NaCl是离子晶体而SiCl4是分子晶体。(2分) (3)平面三角形(2分) (4)1s22s22p63s23p63d10或〔Ar〕3d10(1分),[Cu(NH3)4]2+(1分)。 (5)O=C=O或 S=C=S(2分,写CO2或CS2给1分)。sp杂化(2分)。 (6)CuO(2分) |
试题分析:根据题意,A原子核外有三个未成对电子,其电子排布式为 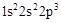 ,A为N元素;A与B形成的一种化合物常温下是红棕色气体,该气体为NO2,则B是O元素;根据E原子核外的M层中只有两对成对电子,其电子排布式为 ,A为N元素;A与B形成的一种化合物常温下是红棕色气体,该气体为NO2,则B是O元素;根据E原子核外的M层中只有两对成对电子,其电子排布式为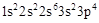 ,则E为S元素;由化合物C2E的晶体为离子晶体,原子序数依次增大,则可知C为Na元素;根据D单质的熔点在同周期单质中最高,可知D是Si元素;根据F原子核外最外层电子数与C相同,其余各层均充满,则F为29号元素,F是Cu元素;据此回答。 ,则E为S元素;由化合物C2E的晶体为离子晶体,原子序数依次增大,则可知C为Na元素;根据D单质的熔点在同周期单质中最高,可知D是Si元素;根据F原子核外最外层电子数与C相同,其余各层均充满,则F为29号元素,F是Cu元素;据此回答。(1)第一电离能同周期从左到右逐渐增大,同一主族,从上到下逐渐减小,N为半充满状态,其稳定性增强,故有Na<Si<O<N ; (2)C的氯化物是NaCl,D的氯化物是SiCl4,因NaCl是离子晶体而SiCl4是分子晶体,所以NaCl的熔点高; (3)E的最高价氧化物是SO3,价层电子全部成键,不存在孤电子对,其分子的空间构型为平面三角形; (4)基态Cu+离子的核外电子排布式为1s22s22p63s23p63d10,Cu2+与NH3可形成4配位的配合物,四氨合铜离子[Cu(NH3)4]2+; (5)A2B是N2O ,它的等电子体是CO2 或CS2,中心原子是碳原子,杂化类型是sp杂化; (6)利用均摊法,该晶胞中含有O: 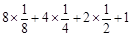 =4,含有Cu:4,故该晶胞化学式为CuO。 =4,含有Cu:4,故该晶胞化学式为CuO。 |
相似问题
短周期元素形成的常见非金属固体单质A与常见金属单质B 在加热条件下反应生成化合物C C与水反应生成白
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E
X元素最高价氧化物对应的水化物为H3XO4 则它对应的气态氢化物为[ ]A.HX B.H2X
X元素最高价氧化物对应的水化物为H3XO4,则它对应的气态氢化物为[ ]A.HX B.H2X C.XH4D.XH3
钛和钛的合金已被广泛用于制造电讯器材 人造骨骼 化工设备 飞机等航天航空材料 被誉为“未来世界的金属
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:(1)钛有和两种原子,它
现在V W X Y Z五种元素 它们的核电荷数依次增大 且都小于20 其中V的一种原子的原子核内没有
现在V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20,其中V的一种原子的原子核内没有中子;W和Y元素原子的最外层电子数相同,且W元素原子L
已知G Q X Y Z均为氯的含氧化合物。我们不了解它们的化学式 但知道它们在一定条件下具有下列转化
已知G、Q、X、Y、Z均为氯的含氧化合物。我们不了解它们的化学式,但知道它们在一定条件下具有下列转化关系(未配平) 这五种化合物中氯的化合价由低到高












