(10分)Ⅰ.(1分Ⅰ)除去气态原子中的一个电子使之成为气态+1价阳离子时所需外界提供的能量叫做该元
(10分)Ⅰ.(1分Ⅰ)除去气态原子中的一个电子使之成为气态+1价阳离子时所需外界提供的能量叫做该元素的第一电离能。下图是周期表中短周期的一部分,其中第一电离能最小的元素是_______. (填字母)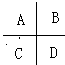 Ⅱ.(6分)德国和美国科学家首先制出由20个碳原子组成的 空心笼状分子C20,该笼状结构是由许多正五边形构成(如图)。请回答: 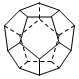 C20分子共有_______个正五边形,共有_______条棱边,C20晶体属于_______ (填晶体类型). Ⅲ. (3分)晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如图所示。 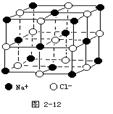 (1)晶体中每个Na+同时吸引着______个Cl-,每个Cl-同时吸引着_______个Na+。 (2)晶体中在每个Cl-周围与它最接近且距离相等 的Cl-共有________个。 |
参考解答
| Ⅰ.C(1分) ;Ⅱ.12. (2分)30(2分);分子晶体(2分)。 Ⅲ.6(1分) ;6(1分) ;12(1分) |
| Ⅰ.金属性越强,第一电离能越小。根据元素周期律可知C的金属性最强,所以第一电离能最小。 Ⅱ.根据结构图可知,每个碳原子形成3个C-C键,1个C-C键由2个电子形成,所以含有的棱边是 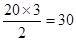 。每个棱边被2个相邻的正五边形共用,所以平均每个正五边形拥有2.5个棱边,因此正五边形的个数是 。每个棱边被2个相邻的正五边形共用,所以平均每个正五边形拥有2.5个棱边,因此正五边形的个数是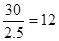 。该化合物中含有分子,属于分子晶体。 。该化合物中含有分子,属于分子晶体。Ⅲ.根据晶胞的结构示意图可知每个钠离子同时吸引着6个氯离子,即上下、左右、前后各1个。反过来,每各氯离子同时吸引着6各钠离子。根据示意图可知晶体中在每个Cl-周围与它最接近且距离相等的Cl-位于面的中心处,共3各。由于每个顶点可以形成8各立方体,所以个数是 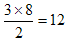 。 。 |
相似问题
食盐晶体如下图所示。在晶体中 ·表示Na+ o表示Cl-。已知食盐的密度为r g/cm3 NaCl摩
食盐晶体如下图所示。在晶体中,·表示Na+,o表示Cl-。已知食盐的密度为r g cm3,NaCl摩尔质量M g mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的
有关晶格能的叙述正确的是A.晶格能是气态离子形成1摩离子晶体释放的能量B.晶格能通常取正值 但是有时
有关晶格能的叙述正确的是A.晶格能是气态离子形成1摩离子晶体释放的能量B.晶格能通常取正值,但是有时也取负值C.晶格能越大,形成的离子晶体越不稳定D
下列有关说法正确的是( )A.乙醇与浓硫酸170℃共热 制得的气体直接通入溴水 可检验制得的气
下列有关说法正确的是( )A.乙醇与浓硫酸170℃共热,制得的气体直接通入溴水,可检验制得的气体是否为乙烯B.合成氨工业中,利用氨易液化,分离出N2、H2
(10分)已知一些单质 化合物的沸点(1.01×105Pa 单位:℃)如下表所示:结合上表有关信息回
(10分)已知一些单质、化合物的沸点(1 01×105Pa,单位:℃)如下表所示:结合上表有关信息回答下列问题:(1)判断下列说法不正确的是 A.同周期元素
下列分子晶体:①HCl ②HBr ③HI ④CO ⑤N2 ⑥H2熔沸点由高到低的顺序是 A
下列分子晶体:①HCl ②HBr ③HI ④CO ⑤N2 ⑥H2熔沸点由高到低的顺序是A.①②③④⑤⑥B.③②①⑤④⑥C.③②①④⑤⑥D.⑥⑤④③②①












