元素X 位于第四周期 其基态原子的内层轨道全部排满电子 且最外层电子数为2。元素Y基态原子的3p轨道
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。 (1)X与Y所形成化合物晶体的晶胞如右图所示。 ①在1个晶胞中,X离子的数目为 。 ②该化合物的化学式为 。 (2)在Y的氢化物分子中,Y原子轨道的杂化类型是 。 (3)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是 。 (4)Y 与Z 可形成YZ42- ①YZ42-的空间构型为 。 ②写出一种与YZ42-互为等电子体的分子的化学式: 。 (5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。 |
参考解答
| .(10分)(1)①4 (1分) ②ZnS(1分) (2)sp3(2分) (3)水分子与乙醇分子之间形成氢键(2分) (4)①正四面体(1分) ②CCl4或SiCl4等(1分) (5)16NA或16×6. 02×1023个(2分) |
试题分析:元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y是S元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素。 (1)①根据晶胞的结构并依据均摊法可知,X离子数目= 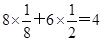 。 。②该晶胞中Y离子数目=4,所以X和Y离子数目之比等于4:4即1:1,所以该化合物的化学式为ZnS。 (2)在H2S中硫原子的价层电子数=2+(6-2×1)÷2=4,所以采用sp3杂化。 (3)在乙醇的水溶液中,水分子和乙醇分子之间易形成氢键,氢键的存在导致其溶解性增大。 (4)①SO42-中价层电子数=4+(6+2-4×2)÷2=4,由于没有孤电子对,所以是正四面体结构。 ②原子数和价电子数均相等的是等电子体,所以与YZ42-互为等电子体的分子的化学式为CCl4或SiCl4 等。 (5)单键都是σ键,所以1mol配合物[X(NH3)4Cl2中,σ键数目=(3×4+4)NA=16NA。 点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养。本题考查的知识点比较多,涉及化学式的确定、氢键、杂化方式的判断等知识点,明确化学式的确定方法、氢键对物质性质的影响、杂化方式的判断方法等是解本题关键,注意配合物[Zn(NH3)4Cl2中,配位键也是σ键,为易错点。 |
相似问题
(10分)Ⅰ.(1分Ⅰ)除去气态原子中的一个电子使之成为气态+1价阳离子时所需外界提供的能量叫做该元
(10分)Ⅰ (1分Ⅰ)除去气态原子中的一个电子使之成为气态+1价阳离子时所需外界提供的能量叫做该元素的第一电离能。下图是周期表中短周期的一部分,其中
食盐晶体如下图所示。在晶体中 ·表示Na+ o表示Cl-。已知食盐的密度为r g/cm3 NaCl摩
食盐晶体如下图所示。在晶体中,·表示Na+,o表示Cl-。已知食盐的密度为r g cm3,NaCl摩尔质量M g mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的
有关晶格能的叙述正确的是A.晶格能是气态离子形成1摩离子晶体释放的能量B.晶格能通常取正值 但是有时
有关晶格能的叙述正确的是A.晶格能是气态离子形成1摩离子晶体释放的能量B.晶格能通常取正值,但是有时也取负值C.晶格能越大,形成的离子晶体越不稳定D
下列有关说法正确的是( )A.乙醇与浓硫酸170℃共热 制得的气体直接通入溴水 可检验制得的气
下列有关说法正确的是( )A.乙醇与浓硫酸170℃共热,制得的气体直接通入溴水,可检验制得的气体是否为乙烯B.合成氨工业中,利用氨易液化,分离出N2、H2
(10分)已知一些单质 化合物的沸点(1.01×105Pa 单位:℃)如下表所示:结合上表有关信息回
(10分)已知一些单质、化合物的沸点(1 01×105Pa,单位:℃)如下表所示:结合上表有关信息回答下列问题:(1)判断下列说法不正确的是 A.同周期元素












