硒是一种非金属 可以用作光敏材料 电解锰行业催化剂。(l)Se是元素周期表中第34号元素 其基态原子
| 硒是一种非金属,可以用作光敏材料、电解锰行业催化剂。 (l)Se是元素周期表中第34号元素,其基态原子的核外电子排布式为 。 (2)根据价层电子对互斥理论,可以推知SeO3的分子空间构型为 ,其中Se原子采用的轨道杂化形式为 。 (3)CSe2与CO2结构相似,CSe2分子内σ键与π键个数之比为 。CSe2首次是由H2Se与CCl4反应后制取的,CSe2分子内的Se—C—Se键角 (填“大于”,“等于”或“小于”)H2Se分子内的H—Se—H键角。 (4)硒化铷晶体属于反萤石型结构,晶胞结构如图所示。每个晶胞中包含 个Rb2Se单元,其中Se2-周围与它距离最近且相等的Rb+的离子数目为 。 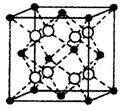 |
参考解答
| (8分)(1)1s22s22p63s23p63d104s24p4(2分) (2)平面三角形;sp2(2分) (3)1:1;大于(2分) (4)4;8(2分) |
试题分析:(l)硒是34号元素,基态原子核外有34个电子,所以根据构造原理可知,其基态原子核外电子排布式为1s22s22p63s23p63d104s24p4。 (2)根据价层电子对互斥理论可知,SeO3的分子中中心原子含有的孤对电子对数=(6-3×2)÷2=0。这说明分子中含有3个价层电子对,且没有孤电子对,所以其空间构型是平面三角形,采用sp2杂化。 (3)二氧化碳分子中含有2个碳氧双键,单键都是σ键,双键是由1个σ键与1个π键构成的,所以CO2分子内σ键与π键个数之比为2:2=1:1。CSe2与CO2结构相似,所以CSe2分子内σ键与π键个数之比也是1:1。二氧化碳是直线型分子,H2Se分子与水分子的空间构型相似,剩余v型分子,所以CSe2分子内的Se-C-Se键角大于H2Se分子内的H-Se-H键角。 (4)根据晶胞的结构可知,白色球都在晶胞内部,所以该晶胞中含有白色球个数=8,黑色球个数=8×  +6× +6× =4,所以每个晶胞中包含4个Rb2Se单元。由于1个面被8个面共用,根据晶胞结构可知,最上面面心上的Se2-距离最近且相等的Rb+的离子数目是8个。 =4,所以每个晶胞中包含4个Rb2Se单元。由于1个面被8个面共用,根据晶胞结构可知,最上面面心上的Se2-距离最近且相等的Rb+的离子数目是8个。 |
相似问题
下表给出几种氯化物的熔沸点 对此有下列说法:①CaCl2属于离子晶体②SiCl4是分子晶体③NaCl
下表给出几种氯化物的熔沸点,对此有下列说法:①CaCl2属于离子晶体②SiCl4是分子晶体③NaCl熔融可导电④MgCl2水溶液不能导电NaClMgCl2CaCl2SiCl4熔点(℃
C60以其完美的球形结构受到科学家的高度重视 从此掀起了球形分子的研究热潮。继C60后 科学家又合成
C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮。继C60后,科学家又合成了Si60、N60等球形分子。(1)科学家把C60和钾掺杂在
下列图式表示的是石墨 氯化钠 干冰 金刚石四种晶体中微粒的排列方式则这四种物质中对应熔点最低的排列方
下列图式表示的是石墨、氯化钠、干冰、金刚石四种晶体中微粒的排列方式则这四种物质中对应熔点最低的排列方式是A.XB.YC.ZD.W
有关晶体结构的叙述中 错误的是( )A.金刚石的网状结构中 最小的环上有6个碳原子B.分子晶体熔化
有关晶体结构的叙述中,错误的是( )A.金刚石的网状结构中,最小的环上有6个碳原子B.分子晶体熔化时,不破坏共价键;原子晶体熔化时,破坏共价键C.
下列晶体按A1型方式进行紧密堆积的是( )。A.干冰 NaCl 金属铜B.ZnS 金属镁 氮化硼C
下列晶体按A1型方式进行紧密堆积的是()。A.干冰、NaCl、金属铜B.ZnS、金属镁、氮化硼C.水晶、金刚石、晶体硅D.ZnS、NaCl、金属镁












